电极电势的应用
电极电势的应用dianji dianshi de yingyong
标准电极电势ψ 是很重要的物理量,运用ψ 数据和测定电动势的方法,可以解决许多化学上的实际问题。
❶ 判断反应趋势 电极电势的高低,反映了电极反应物质得失电子能力的大小,电极电势越低,越容易失电子; 电极电势越高,越容易得电子。因此可利用电极电势的数值来判断反应趋势。例如,电极电势较低的金属元素能从溶液中置换出电极电势较高的金属元素。根据能斯特方程,电极电势ψ是由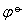 和离子活度两个因素决定的,因此两电极进行比较,当
和离子活度两个因素决定的,因此两电极进行比较,当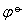 值相差较大,或活度相近时,可用
值相差较大,或活度相近时,可用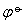 的数值来判断反应的趋势; 当
的数值来判断反应的趋势; 当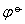 相差不大,而有关活度相差很大时,则需用ψ值相比较来判断。
相差不大,而有关活度相差很大时,则需用ψ值相比较来判断。
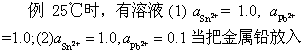
解 查得
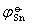 =-0.136V;
=-0.136V;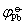 =-0.126V
=-0.126V(1) Pb2+,Sn2+活度均为1.0时,
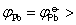
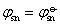 所以铅不能置换出锡。
所以铅不能置换出锡。
❷求化学反应的平衡常数已知
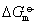 =-RTlnKa,又
=-RTlnKa,又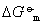 =-nFE,所以化学反应的平衡常数Ka与该反应对应的电池电动势E的关系式:
=-nFE,所以化学反应的平衡常数Ka与该反应对应的电池电动势E的关系式:
❸求难溶盐的活度积 把难溶盐的溶解过程设计成一个电池,便可由电池的电动势求难溶盐的活度积。
例 求AgCl的活度积Ksp。

测定溶液PH值 用电动热法测溶液的PH值,需要电极为时已晚热己知的参比电极(通常用甘汞电极)和另一个对H+可逆的电极(氢电极、醌氢醌电极或玻璃电极)组成电池。例如,下列电池Pt
E=ψ甘汞-ψH2
=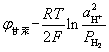

☚ 盐桥 电镀 ☛
- 有关于黄果树瀑布亭联的对联大全是什么意思
- 有关于黄河三峡联的对联大全是什么意思
- 有关于黄继光烈士纪念碑联的对联大全是什么意思
- 有关于黄花岗烈士陵园联的对联大全是什么意思
- 有关于黑夜的名言名句集锦是什么意思
- 有关于龙门石窟联的对联大全是什么意思
- 有关于龙门联的对联大全是什么意思
- 有关人物和行为的虚词是什么意思
- 有关人的特性的四种假设是什么意思
- 有关人类特性的四种假设是什么意思
- 有关仙道的玄理是什么意思
- 有关兄弟之典故是什么意思
- 有关再投资的规定是什么意思
- 有关军事的是什么意思
- 有关刑法的是什么意思
- 有关双方是什么意思
- 有关古代印度的是什么意思
- 有关各方是什么意思
- 有关国家民族存亡的大事是什么意思
- 有关大局的道理是什么意思
- 有关大雁塔是什么意思
- 有关学科是什么意思
- 有关家国书常读 无益身心事莫为是什么意思
- 有关小说的评论文章是什么意思
- 有关年节的是什么意思
- 有关当局是什么意思
- 有关录是什么意思
- 有关征战的事是什么意思
- 有关战争的事是什么意思
- 有关文件是什么意思
- 有关方面是什么意思
- 有关欧共与社会民主党的理论要点是什么意思
- 有关爱情的事是什么意思
- 有关田产的诉讼是什么意思
- 有关男女情爱的诗句是什么意思
- 有关的事物是什么意思
- 有关的人是什么意思
- 有关的组织、机构等收留是什么意思
- 有关盗贼的案件是什么意思
- 有关盗铸钱币的案件是什么意思
- 有关穴位是什么意思
- 有关系是什么意思
- 有关组织是什么意思
- 有关经济体制改革的三点意见是什么意思
- 有关结婚的事是什么意思
- 有关考证的记载是什么意思
- 有关耕获的时令节气是什么意思
- 有关行话中的数字隐语是什么意思
- 有关褒姒的身世传说是什么意思
- 有关讲授内容的材料是什么意思
- 有关诉讼和违法的事件是什么意思
- 有关诗歌的评论创作理论的著作是什么意思
- 有关诗的论说是什么意思
- 有关货样是什么意思
- 有关贩卖或吸食鸦片的案件是什么意思
- 有关贼盗的案情是什么意思
- 有关选任官吏事项的簿书是什么意思
- 有关道德的行为是什么意思
- 有关部门是什么意思
- 有关部门特别许可是什么意思