玻尔轨道
玻尔轨道boer guidao
玻尔理论中电子绕核运动的稳定轨道。按照玻尔理论,原子的不同能量状态对应电子的不同运行轨道。由于原子的能量状态是不连续的,因而电子的轨道也是不连续的。电子只能在满足条件:P=n·h/2π(P为电子的角动量,h为普朗克常量,n为正整数)的轨道上运动。电子在这些轨道上运动时处于稳定状态,不向外辐射能量。只有当电子从具有较高能量的轨道上跃迁到较低能量的轨道上时,才辐射能量。辐射的能量为这两条轨道所对应的能量差。氢原子的玻尔轨道如图所示。它是一组分立的、以原子核为圆心的同心圆。各轨道半径及所对应的能量可用式:rn=n2r1、En=1/n2E1计算。式中n=1,2,3……,r1为离核最近的一条轨道的半径,其值为r0=0.529×10-10米,称为玻尔半径,E1为基态能量,其值为-13.6电子伏特。
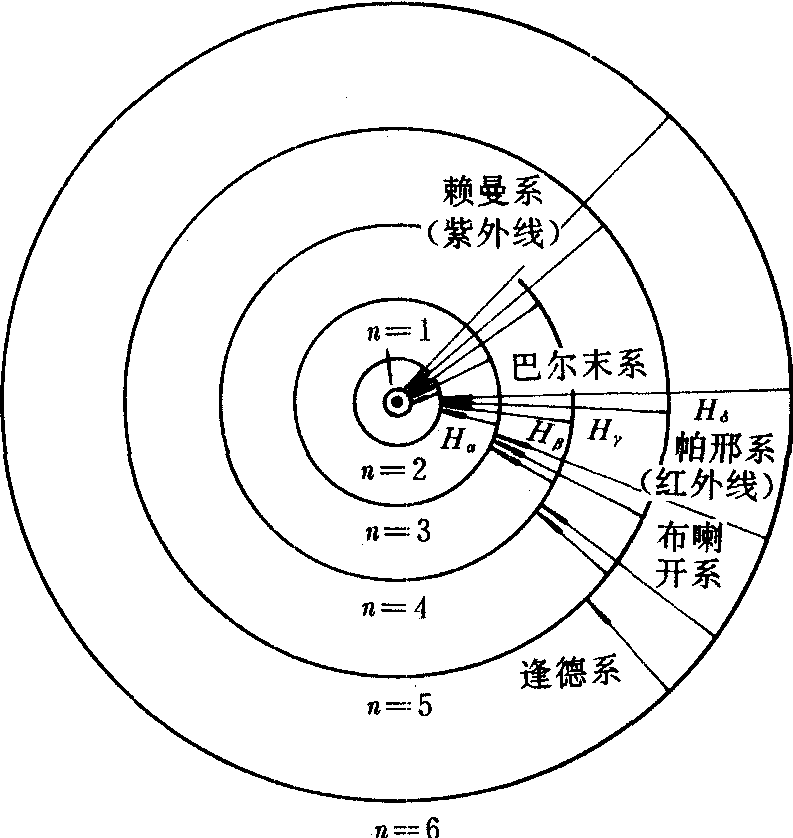
按照量子力学理论,核外电子的运动并没有确定的轨道。电子可能在原子内各处出现,只是出现的概率不同。原子中电子出现概率最大的区域是以原子核为中心的一个球壳,这个球壳的半径为0.53×10-10米。这恰与玻尔半径相同,说明玻尔的电子轨道只不过是电子出现概率最大的地方。在量子力学中把电子当作电荷密度ρ=eφ*φ的“带电的云”,用这种“电子云”来描述电子在核外运动的情况。
玻尔理论对原子的结构按电子轨道运动的描述提供了一幅简单的原子结构图。在一定范围内所得的推论和实验一致,特别是对氢原子光谱的解释很成功,具有一定的真实性。但是玻尔轨道的描述方式又是很不完善的,只能计算氢原子和类氢原子的光谱频率,对于稍复杂的原子(例如由一个原子核和两个电子组成的氦原子),就难以用玻尔轨道描述了。对于原子的复杂问题,可以用玻尔轨道概念作一些初步的分析和定性的估计。因此,在初学原子结构及解释一些简单现象时还常常用到玻尔轨道的概念。
☚ 电离 电子壳层 ☛
玻尔轨道
Bohr orbit
- kyam是什么意思
- kyang是什么意思
- kyanite是什么意思
- kyat是什么意思
- kyd,thomas是什么意思
- kye是什么意思
- kyedok是什么意思
- kyek是什么意思
- kyem是什么意思
- kyengkyeng是什么意思
- kyet是什么意思
- kyetkyet是什么意思
- kyi是什么意思
- kyik是什么意思
- kyikyi是什么意思
- kyim是什么意思
- kyin是什么意思
- kyindut是什么意思
- kying是什么意思
- kyin gadep是什么意思
- kying htang是什么意思
- kying nang是什么意思
- kyinkyin是什么意思
- kyip是什么意思
- kyit是什么意思
- kyitkyit是什么意思
- kymogram是什么意思
- kyo是什么意思
- kyoga,lake是什么意思
- kyok是什么意思
- kyokyo是什么意思
- kyom是什么意思
- kyomkyom是什么意思
- kyongsong是什么意思
- kyoto是什么意思
- kyoto 京都是什么意思
- kypfos是什么意思
- kyprianou,spyros是什么意思
- kyrgyzstan是什么意思
- kyros是什么意思
- kyt1【口讲指画】是什么意思
- kyu是什么意思
- kyu hpyi是什么意思
- kyu htam是什么意思
- kyukya是什么意思
- kyukyu是什么意思
- kyushu是什么意思
- kyushu 九州岛是什么意思
- kyzr【口诛笔伐】是什么意思
- kyzyl(或kizil)kum是什么意思
- kz12【啼笑皆非】是什么意思
- kz56【品竹弹丝】是什么意思
- kzrs【唱筹量沙】是什么意思
- k·a(-)是什么意思
- k·ai(-)是什么意思
- k·ai(ˇ)是什么意思
- k·ai(ˋ)是什么意思
- k·an(-)是什么意思
- k·ang(-)是什么意思
- k·ang(ˇ)是什么意思