溶液中离子大量共存的条件
溶液中离子大量共存的条件rongyezhong lizi dali-ang gongcun de tiaojian
在溶液中,两种或两种以上离子之间发生以下类型反应时,则不能大量共存:
❶发生复分解反应,生成难溶的酸、碱、盐沉淀。例如:
2H++SiO2-3+H2O=H4SiO4↓
Mg2++2OH-=Mg(OH)2↓
Cu2++S2-=CuS↓
❷发生复分解反应,生成酸性气体或碱性气体。例如:
2H++S2-=H2S↑
2H++SO2-3=H2O+SO2↑
NH+4+OH-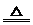 NH3↑+H2O
NH3↑+H2O
❸发生复分解反应,生成弱酸、弱碱和水等弱电解质。例如:
H++CH3COO-=CH3COOH
NH+4+OH-=NH3·H2O
HCO-3+OH-=H2O+CO2-3
❹发生双水解反应且进行得较完全。例如:
Fe3++3HCO-3=Fe(OH)3↓+3CO2↑
Al3++3AlO-2+6H2O=4Al(OH)3 ↓
NH+4+CH3COO-+H2O![]() NH3·H2O+CH3COOH
NH3·H2O+CH3COOH
NH+4,CH3COO-在溶液中可大量共存。
❺发生氧化-还原反应。例如:
3Fe2++4H++NO-3=3Fe3++NO↑+2H2O
2MnO-4+5SO2-3+6H+=2Mn2++5SO2-4+3H2O
❻形成配离子或配合物。例如:
Fe3++SCN-=[Fe(SCN)]2+
Cu2++4NH+4+4OH-=[Cu(NH3)4]2++4H2O
Fe3++3SCN-=Fe(SCN)3
☚ 离子反应 电解质溶液的电解反应 ☛
- 眼楞急是什么意思
- 眼横秋水是什么意思
- 眼橛是什么意思
- 眼檐是什么意思
- 眼欠是什么意思
- 眼毒是什么意思
- 眼毒理学是什么意思
- 眼毛是什么意思
- 眼毛浆米汤是什么意思
- 眼毛短——分不出高低是什么意思
- 眼毛长是什么意思
- 眼气是什么意思
- 眼气巴啦是什么意思
- 眼水是什么意思
- 眼水好是什么意思
- 眼汁是什么意思
- 眼汆起酒盏儿能是什么意思
- 眼污是什么意思
- 眼汪是什么意思
- 眼沙是什么意思
- 眼没水是什么意思
- 眼沿是什么意思
- 眼泉是什么意思
- 眼法是什么意思
- 眼泡是什么意思
- 眼泡儿是什么意思
- 眼泡子是什么意思
- 眼泡痰核是什么意思
- 眼泡皮是什么意思
- 眼泡红肿是什么意思
- 眼波是什么意思
- 眼波才动被人猜。是什么意思
- 眼波欲逐川流去,眉翠常含风色愁。是什么意思
- 眼泣水是什么意思
- 眼泪是什么意思
- 眼泪一把,鼻涕一把是什么意思
- 眼泪一横是什么意思
- 眼泪不出是什么意思
- 眼泪之路是什么意思
- 眼泪像断了线的珍珠一般纷纷落下是什么意思
- 眼泪儿巴撒是什么意思
- 眼泪出是什么意思
- 眼泪办不了事是什么意思
- 眼泪叭嚓是什么意思
- 眼泪叮当是什么意思
- 眼泪和鼻涕是什么意思
- 眼泪和鼻涕不断流下是什么意思
- 眼泪哭干,内心悲伤是什么意思
- 眼泪围着眼圈儿转是什么意思
- 眼泪多显是什么意思
- 眼泪婆娑是什么意思
- 眼泪巴嚓是什么意思
- 眼泪巴撒是什么意思
- 眼泪巴擦是什么意思
- 眼泪巴查是什么意思
- 眼泪巴沙是什么意思
- 眼泪帕擦是什么意思
- 眼泪往肚子里流是什么意思
- 眼泪往肚里咽是什么意思
- 眼泪往肚里流是什么意思