溶度积
溶度积rongduji
自然界没有绝对不溶解的物质,许多通常认为不溶于水的物质也有微弱溶解于水的倾向,例如难溶盐氯化银在水中存在沉淀与溶解平衡。在一定温度下,Ag+浓度和Cl-浓度的乘积为一定值。如果对一般难溶盐强电解质在水中同样存在
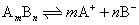
在 一定温度下,则
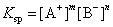
式中Ksp为常数,它反映了物质的溶解能力,故称溶度积常数,简称溶度积。其意义: 在难溶强电解质饱和溶液中,组成该物质的各离子浓度的系数次方之积,在一定温度下为该物质固有的常数。所谓难溶强电解质,可以是盐,亦可以是碱。严格说,Ksp应是难溶电解质在其饱和溶液中离子活度的系数次方之积,称为活度积。因难溶电解质其溶度积很小,离子浓度近似地等于活度。任何难溶电解质,不管它的溶解度多么小,在其饱和溶液中总有与其达成平衡的离子。任何沉淀反应,无论它进行得多么完全,溶液中仍依然存在组成它的离子,而且其离子浓度系数次方之积必为常数。只不过随难溶电解质的溶解能力的差异,Ksp值有所不同。
溶度积可由该难溶电解质的溶解度求得。例如,设氯化铅在水中的溶解度为s(mol·L-1),该盐在饱和溶液中完全电离
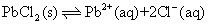
Pb2+的浓度为s,Cl-的浓度为2s,故
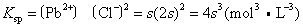
溶度积的应用很广泛。在定性分析中,利用金属硫化物、氢氧化物、碳酸盐等溶度积的差异分离金属离子。若往氯化铅饱和溶液中加入氯化钾时,溶液中Cl-浓度增大,Pb2+和Cl-的浓度系数次方之积较氯化铅的溶度积大,这时将有部分离子发生Pb2++2Cl-→PbCl2的反应,将过剩的PbCl2沉淀出来,直至两种离子的浓度系数次方之积等于氯化铅的溶度积为止。因此,为使溶解度小的物质完全沉淀,需要加入含有共同离子的电解质。一些常见的难溶电解质的Ksp值见下表。
难溶电解质的溶度积常数 25℃
| 化合物 | KSP | 化合物 | KSP | 化合物 | KSP |
| AgCl | 1.56×10-10 | Mg(OH)2 | 2×10-11 | HgS | 3×10-52 |
| AgBr AgI Hg2Cl2 PbCl2 CaCO3 BaCO3 | 7.7×10-13 1.5×10-16 2×10-18 2.1×10-5 8.7×10-9 8.7×10-9 | Fe(OH)3 PbSO4 CaSO4 SrSO4 BaSO4 Ag2S | 6×10-38 1.1×10-8 6.2×10-5 2.8×10-7 2.0×10-10 1.6×10-49 | CuS PbS ZnS CoS NiS MnS | 8×10-36 1×10-28 1.1×10-24 8×10-23 2×10-21 1.4×10-15 |
☚ 同时化学平衡 配离子的不稳定常数 ☛
- 跛踬是什么意思
- 跛踵是什么意思
- 跛踷是什么意思
- 跛蹇是什么意思
- 跛蹇驽弱的驴子是什么意思
- 跛蹩是什么意思
- 跛蹶是什么意思
- 跛蹻是什么意思
- 跛躃是什么意思
- 跛躄是什么意思
- 跛道是什么意思
- 跛道人是什么意思
- 跛驴是什么意思
- 跛驴之伍是什么意思
- 跛驴配着破口袋——一摊破货是什么意思
- 跛骹是什么意思
- 跛骼是什么意思
- 跛骼盖是什么意思
- 跛鳖是什么意思
- 跛鳖千里是什么意思
- 跛鸭是什么意思
- 跛鸭修正案是什么意思
- 跛鼈是什么意思
- 跜是什么意思
- 距是什么意思
- 距是什么意思
- 距下关节是什么意思
- 距人千里是什么意思
- 距今是什么意思
- 距今不远是什么意思
- 距关是什么意思
- 距击是什么意思
- 距后三角骨损伤是什么意思
- 距地面较高的空间是什么意思
- 距堙是什么意思
- 距塞是什么意思
- 距大陆远的海洋是什么意思
- 距实现目标、愿望的时间还很长是什么意思
- 距开始的时间很长是什么意思
- 距恶是什么意思
- 距战是什么意思
- 距捍是什么意思
- 距来是什么意思
- 距某个时期或某件事情的时间不远是什么意思
- 距点是什么意思
- 距状动脉是什么意思
- 距状裂是什么意思
- 距现在较近的时代是什么意思
- 距现在较远的时代是什么意思
- 距矱绳尺是什么意思
- 距石是什么意思
- 距离是什么意思
- 距离与美是什么意思
- 距离仰角显示器是什么意思
- 距离修正量是什么意思
- 距离分辨是什么意思
- 距离分辨率是什么意思
- 距离判别是什么意思
- 距离地面是什么意思
- 距离大是什么意思