浓缩析晶计算
浓缩析晶计算nongsuo xijing jisuan
将饱和溶液浓缩(恒温蒸发或加热蒸发)必然有溶质晶体析出,析出溶质晶体的量可根据浓缩时溶液损失的溶剂的质量和溶质的溶解度进行计算。
恒温蒸发溶液失掉的溶剂的质量为m(A),该温度下物质的溶解度为s,浓缩析出的溶质晶体的质量为m(B),根据溶解度定义计算析出的晶体量:
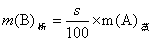
例 30℃的氯化钾饱和溶液250g,在温度不变的条件下蒸发掉40 g水,问应有多少克氯化钾晶体析出,留下的饱和溶液是多少克?
解 查出30℃KCl的溶解度为37g,
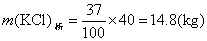
250-(14.8+40)=195.2(g)
答 析出 KCl晶体 14.8g,剩留饱和溶液195.2g。
如果溶液被加热蒸发失去溶剂A,再降温析出晶体,计算时先查出溶质在不同温度下的溶解度,再按照上式可计算溶液浓缩析出的溶质晶体量。
例 工业制糖过程中,100℃时将蔗糖(B)饱和溶液30 kg加热蒸发掉4.5 kg水,再降温到60℃结晶,问析出蔗糖多少千克?
解 查出蔗糖在100℃的溶解度是487.2g,在60℃的溶解度是287.3g。100℃析出的蔗糖:
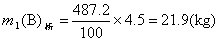
剩留100℃蔗糖饱和溶液:30-(21.9+4.5) =3.6(kg)
100℃饱和溶液降温至60℃时析出的蔗糖:(100+487.2):(487.2-287.3)=3.6:m2(B)析
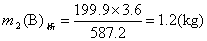
共析出蔗糖晶体:
m(B)析=m1(B)析+m2(B)析=23.1(kg)
答 共析出蔗糖23.1 kg
☚ 降温析晶计算 质量百分比浓度计算 ☛
- 生物物理学是什么意思
- 生物物理学引论是什么意思
- 生物物理被害人是什么意思
- 生物物理遗传学是什么意思
- 生物物质是什么意思
- 生物球粒亮晶灰岩是什么意思
- 生物球粒微晶灰岩是什么意思
- 生物生活史是什么意思
- 生物电是什么意思
- 生物电之谜是什么意思
- 生物电位是什么意思
- 生物电分析化学是什么意思
- 生物电化学是什么意思
- 生物电化学是什么意思
- 生物电化学传感器是什么意思
- 生物电子显微技术是什么意思
- 生物电检查器械是什么意思
- 生物电池是什么意思
- 生物电现象是什么意思
- 生物电现象是什么意思
- 生物的基本知识是什么意思
- 生物监测是什么意思
- 生物监测是什么意思
- 生物监测及其阈限值研究进展是什么意思
- 生物研究会是什么意思
- 生物碎屑岩是什么意思
- 生物碱是什么意思
- 生物碱中毒是什么意思
- 生物碱中毒是什么意思
- 生物碱显色剂是什么意思
- 生物碱沉淀型是什么意思
- 生物磁学是什么意思
- 生物礁是什么意思
- 生物礁环境与成矿是什么意思
- 生物社会行为论是什么意思
- 生物种群增长的营养动力学是什么意思
- 生物积累是什么意思
- 生物素是什么意思
- 生物细胞冷冻蚀刻电镜技术是什么意思
- 生物统计学是什么意思
- 生物统计学是什么意思
- 生物统计程序集操作指南是什么意思
- 生物群落是什么意思
- 生物群落是什么意思
- 生物聚合物波谱学导论是什么意思
- 生物能量分析是什么意思
- 生物膜是什么意思
- 生物膜法是什么意思
- 生物膜的结构与功能是什么意思
- 生物致畸因素是什么意思
- 生物药剂学是什么意思
- 生物药剂学是什么意思
- 生物评价方法是什么意思
- 生物质能是什么意思
- 生物质能是什么意思
- 生物资源是什么意思
- 生物资源是什么意思
- 生物资源是什么意思
- 生物资源是什么意思
- 生物资源保护是什么意思