活化能与反应热的关系
活化能与反应热的关系huohuaneng yu fanyingrede guanxi
对某可逆反应,由热力学结论,平衡常数KC随温度的变化关系为
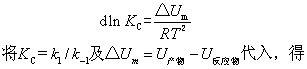
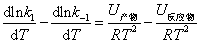
式中K1,K-1分别表示正、逆反应的速率常数。根据阿仑尼乌斯的观点,两个反应物分子碰撞,在变成产物之前需要经过一个活化态,反应物、产物和活化态的能量间的关系见下图。
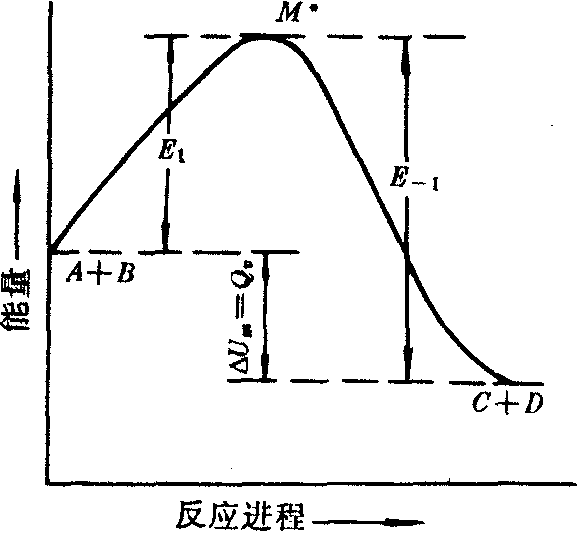
正、逆反应活化能与反应热的关系
E1为正向反应的活化能; E-1是逆反应的活化能。
根据阿仑尼乌斯经验式,对该可逆反应有
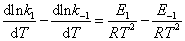
比较上述两式,可得
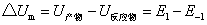
该式表明正、逆向反应活化能之差为反应的等容反应热△Um。若在反应温度不高的情况下,则等容反应热△U近似等于等压反应热△Hm,故
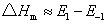
基元反应的活化能为正值。对正、逆向反应均为基元反应,如果反应为放热,即△Hm<0,由
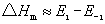
得知E1
☚ 活化能 反应速率 ☛
- 将草是什么意思
- 将莫是什么意思
- 将萎谢的红花是什么意思
- 将落的月是什么意思
- 将落的枯叶是什么意思
- 将葬时的祭奠是什么意思
- 将虞候是什么意思
- 将虾吊鲤是什么意思
- 将虾钓鲤是什么意思
- 将虾钓鳖是什么意思
- 将蛋是什么意思
- 将蜂是什么意思
- 将蜢船儿是什么意思
- 将行是什么意思
- 将行美政,必先择人是什么意思
- 将补鸾凤巢,免与枭鸢并。是什么意思
- 将被攻破的城是什么意思
- 将裘换酒是什么意思
- 将要是什么意思
- 将要下雪的景象是什么意思
- 将要倒塌的墙是什么意思
- 将要出现的景象是什么意思
- 将要到口是什么意思
- 将要到口,可以滑落;将要成事,可以败功是什么意思
- 将要升官是什么意思
- 将要发生战乱等灾祸的预兆是什么意思
- 将要失传的学问典籍是什么意思
- 将要成事是什么意思
- 将要或正在吐丝的蚕是什么意思
- 将要死亡或已经死亡是什么意思
- 将要离别是什么意思
- 将要醉的感觉是什么意思
- 将解决局部问题的经验普遍推广,以带动全面发展是什么意思
- 将计就计是什么意思
- 将计就计,郭崇韬大败彦章是什么意思
- 将计就计,顺手牵羊是什么意思
- 将诚是什么意思
- 将诚勇以力相敌,不过数人极矣是什么意思
- 将调梅铉实,不正李园冠。是什么意思
- 将谋兵精是什么意思
- 将谋欲密是什么意思
- 将谋欲密,士众欲一,攻敌欲疾。是什么意思
- 将谓是什么意思
- 将谢或凋残的花是什么意思
- 将贤则胜是什么意思
- 将贪财则奸不禁,将内顾则士卒慕是什么意思
- 将贵专谋是什么意思
- 将贵专谋,兵以奇胜是什么意思
- 将贵能取胜,尤贵得众心是什么意思
- 将贵自专是什么意思
- 将资料、人、物等聚集在一起是什么意思
- 将赡才力,务在博见。是什么意思
- 将赴吴兴登乐游原是什么意思
- 将赴吴兴登乐游原一绝是什么意思
- 将赴吴兴登乐游原一绝(杜牧)是什么意思
- 将赴吴兴,登乐游原一绝是什么意思
- 将赴岭外留题萧寺远公院寺即梁朝萧内史创是什么意思
- 将赴草堂途中有作先寄严郑公五首(其四)·[唐]杜甫原是什么意思
- 将身体向前靠近是什么意思
- 将身体靠在他物之上是什么意思