拟卤化物
拟卤化物niluhuawu
由2个或2个以上电负性较大的元素原子组成的原子团,游离状态时,与卤素单质性质相似,阴离子也与卤素阴离子性质相似,故称拟卤素,也称类卤素或假卤素。如氰(CN)2,氧氰(OCN)2,硒氰(SeCN)2,硫氰(SCN)2,叠氮二硫化碳(SCSN3)2等。拟卤素阴离子有氰离子CN-,氰酸根离子OCN-,异氰酸根离子ONC-,硫氰酸根离子SCN-1,异硫氰酸根离子 NCS-,硒氰酸根离子SeCN-,叠氮离子N-3和碲氰根离子TeCN-等。
氰化物是氢氰酸的盐,氢氰酸是弱酸,K=4.93×10-10,氰化物的若干反应与氯化物相同。如与硝酸银反应生成白色氰化银沉淀:
Ag++CN-=AgCN↓
氰离子CN-形成一系列盐类,重金属的氰化物不溶于水,碱金属和碱土金属的氰化物则溶解度很高,并在水中强烈水解,使溶液显碱性:
CN-+H2O=HCN+OH-
4Au+8NaCN+2H2O+O2=4NaAu(CN)2+4NaOH
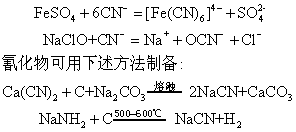
硫氰酸也是弱酸(K=1.4×10-1),其盐中只有少数重金属Cu(Ⅰ),Au(Ⅲ)及Hg(Ⅱ)盐不溶于水,大多数易溶。硫氰酸盐的一个特殊而灵敏的反应是与Fe3+形成深红色的硫氰配离子:
Fe3++nSCN-=[Fe(SCN)n]+(3-n)n=1,2,…6
工业上用氨水和二硫化碳反应制取硫氰酸铵:
4NH3+CS2=NH4SCN+(NH4)2S
氢叠氮酸是弱酸(K=1.9×103)。离子叠氮化物比较稳定,受热缓慢分解。但共价型叠氮化物,如叠氮化银、叠氮化汞等,受热即爆炸。叠氮化铅作为引爆剂广泛用于制造雷管。
☚ 多卤化物 氢氰酸 ☛
- 大丈夫相时而动是什么意思
- 大丈夫相时而动。是什么意思
- 大丈夫能伸能屈是什么意思
- 大丈夫能屈伸是什么意思
- 大丈夫能屈能伸是什么意思
- 大丈夫能屈能伸。是什么意思
- 大丈夫膝下有黄金是什么意思
- 大丈夫行不改姓,坐不更名是什么意思
- 大丈夫行事当磊磊落落,如日月皎然。是什么意思
- 大丈夫行事,当礝礌落落,如日月皎然。是什么意思
- 大丈夫行事,论事非不论利害,论逆顺不论成败,论万事不论一生。是什么意思
- 大丈夫见义勇为是什么意思
- 大丈夫见善明则重名节如泰山,用心刚则轻生死如鸿毛。是什么意思
- 大丈夫说话,如白染皂是什么意思
- 大丈夫赌志不赌气是什么意思
- 大丈夫难免妻不贤、子不孝是什么意思
- 大丈夫难免妻不贤子不孝是什么意思
- 大丈夫难免妻不贤,子不孝是什么意思
- 大丈夫顶天立地是什么意思
- 大丈失儿是什么意思
- 大丈母是什么意思
- 大丈规以信义为重。是什么意思
- 大三是什么意思
- 大三五七散是什么意思
- 大三产是什么意思
- 大三元酒家是什么意思
- 大三关是什么意思
- 大三剪子任家刀是什么意思
- 大三十是什么意思
- 大三口是什么意思
- 大三台沟是什么意思
- 大三巴牌坊是什么意思
- 大三巴牌方邮亭是什么意思
- 大三弦是什么意思
- 大三战是什么意思
- 大三线是什么意思
- 大三脘散是什么意思
- 大三角关系是什么意思
- 大三角外交是什么意思
- 大三角帆是什么意思
- 大三门是什么意思
- 大上元是什么意思
- 大上前夜晚夕是什么意思
- 大上前年是什么意思
- 大上前年个儿是什么意思
- 大上前年子是什么意思
- 大上有立德,其次有立功,其次有立言,虽久不废,此之谓不朽。是什么意思
- 大上海分保集团是什么意思
- 大上海沉没是什么意思
- 大上海的一日是什么意思
- 大上海的毁灭是什么意思
- 大上海美发厅是什么意思
- 大上海计划是什么意思
- 大上皮是什么意思
- 大上立德是什么意思
- 大上造是什么意思
- 大下八雨是什么意思
- 大下小解是什么意思
- 大下饭是什么意思
- 大下麻雨是什么意思