异常血红蛋白
异常血红蛋白是指由于遗传上的缺陷所产生的血红蛋白,其中一种、偶尔几种珠蛋白链的分子结构是异常的。自从1949年Pauling和Itano发现镰形细胞贫血的HbS以来,据1983年国际血红蛋白情报中心报道,全世界范围内经结构分析证实的异常血红蛋白共发现409种,但多数异常血红蛋白不伴有生理功能的改变,故不发生疾病。但有小部分异常血红蛋白因伴有生理功能的改变而可产生疾病,例如血红蛋白的异常可促使红细胞的生存时间缩短而发生溶血或溶血性贫血,或因改变了血红蛋白与氧的亲和力而发生组织缺氧和代偿性红细胞增多症或紫绀,或因产生过多的高铁血红蛋白而发生紫绀。这些异常血红蛋白产生有临床表现的病理状态均称为血红蛋白病。
珠蛋白链的原发异常不一定是质的改变,也可以是量的改变。当一种或一种以上珠蛋白链的合成速度显著减慢或完全不能合成时,可引起血红蛋白中珠蛋白链的不平衡。这种情况虽然也能产生异常的血红蛋白,例如HbH (β4)或Hb Bart′s (γ4),但珠蛋白链本身的分子结构并无异常。这种情况所产生的疾病即海洋性贫血。近年常把这类疾病也包括在血红蛋白病的范围内。
当1949年Pauling首先发现镰形细胞贫血含有异常血红蛋白时,这种异常血红蛋白便称为HbS (S代表sickle,意为镰刀),正常成人的血红蛋白便称为HbA(A代表adult),而正常的胎儿血红蛋白称为HbF (F代表fetal)。此后各种异常血红蛋白就按照发现的先后依次用英文拼音字母命名,如HbC、D、E、G……等。由于新发现的异常血红蛋白越来越多,显然二十几个拼音字母将不够应用,故自HbQ以后,就停止使用这种命名法,决定改用新异常血红蛋白发现所在的实验室、医院、城镇或地区等为名称,如Hb Bart′s、Hb Dakar、Hb Seattle。如果新发现的血红蛋白的电泳速度与已知某种异常血红蛋白相同,而其氨基酸顺序不同,则新的血红蛋白可采用旧的血红蛋白的同一名称,加异常珠蛋白链的名称,再加发现地点的名称,如Hb G Chinese。在实际工作中,珠蛋白链的名称常被省略,故Hb Gα Chinese写成Hb GChinese。一种更加准确识别各种异常血红蛋白的方式是将在不正常珠蛋白链中有突变的氨基酸及其位置写出,如HbS写成α2β26缬或α2β26谷→缬。
血红蛋白病的名称常以表现型而不以遗传型的形式表达,以血红蛋白浓度的高低为先后次序,如将镰形细胞特性写成AS,镰形细胞贫血写成SS。
异常血红蛋白的分子结构改变 血红蛋白并非纯一的物质。正常人出生后的血红蛋白共有三种:
❶血红蛋白A(HbA),即正常成人血红蛋白,由一对α链和一对β链组成(α2β2),占成人血红蛋白的97%左右;
❷血红蛋白A2 (Hb A2),由一对α链和一对δ链组成(α2δ2),在婴儿出生6~12个月后,占所有血红蛋白的2~3%;
❸血红蛋白F(HbF),亦称胎儿血红蛋白,由一对α链和一对γ链组成(α2γ2),婴儿出生时占所有血红蛋白的55~90%,平均约70%,以后很快被HbA所替代,到婴儿出生后4~5月时约为10%,1岁左右时不超过1%(用碱变性试验测定不超过2%)。
α链由141个氨基酸组成,β、δ、γ链均由146个氨基酸组成,δ链与β链的分子结构很相似,(只差10个氨基酸)可视为β链的变异体,γ链的氨基酸顺序与β链也较相似(一级结构)。
整条珠蛋白链弯曲成8个节段,自氨基端起每一节段分别以A至H8个英文字母指称。在此8个节段中的氨基酸均处于螺旋形的位置上,故这些节段称为螺旋节段(helix)图1。在两个螺旋节段之间的氨基酸不处于螺旋形位置,因而使珠蛋白链发生曲折,称为非螺旋节段,这种非螺旋节段共有7个,自N端开始,分别称为NA、AB、CD、EF、FG、GH及HC(二级结构)。
珠蛋白链折叠成一球形单位,血红素处于螺旋节段E及F间形成的一个血红素凹窝或囊(heme pocket)中。正常珠蛋白链的极性氨基酸都处于与水接触的分子面一边,使珠蛋白分子能溶解于水,而面向血红素的氨基酸都是非极性的疏水氨基酸。这种疏水氨基酸相互间的作用产生的Van derWaals力量使珠蛋白与血红素的连结非常牢固,血红蛋白分子的稳定赖以保持。血红素的铁原子除与4个吡咯环的氮原子结合外,还与螺旋节段F8(α87,β92)的组氨酸连结,加强血
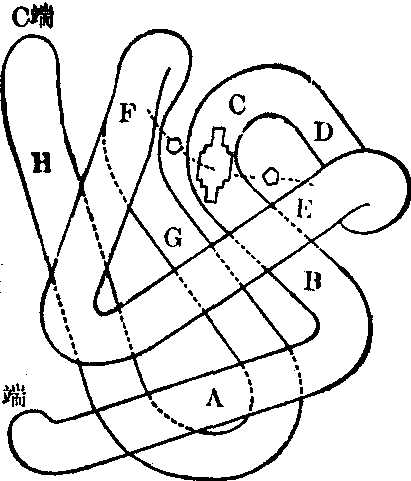
图1 珠蛋白链的螺旋节段示意
大部分氨基酸处于螺旋形位置,组成8个节段,称为螺旋段(A.B.C.D.E.F.G.H),每个节段之间链发生扭曲,以前后两节段的名称为名(NA.AB.CD.EF. FG.GH.HC),此处的氨基酸不处于螺旋形位置。血红素与E和F节段的组氨酸连结。整个珠蛋白链扭曲成球形的三级结构
四条珠蛋白链连接而形成一个近似球形四面体的分子。相同链例如α1α2及β1β2的接触比较少(图2),不
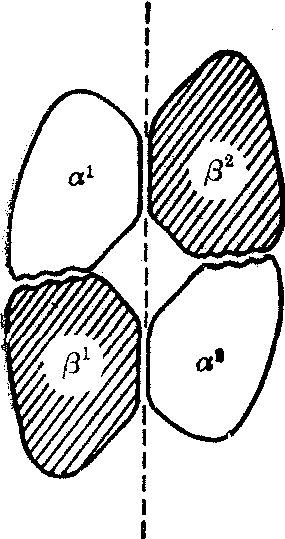
图2 血红蛋白四级结构示意
(仿自Mengel CEet al: Hematol-ogy,Principlesand Practice,Year Book Med-ical Publishers,1973,p. 228)α1-β2及 α2-β1 的接触较少,而α1-β1及α2-β2的接触较多。虚线表示在平面血红蛋白分子可分成两个完全相同的二体
血红蛋白的分子结构与其功能的关系非常密切。血红蛋白分子要保持其功能正常,上述四级分子结构必须保持完整,任何一方面如发生了改变,其结果便是产生异常血红蛋白,并可发生血红蛋白病。珠蛋白中的氨基酸顺序是由有关的基因决定的。故控制珠蛋白链中氨基酸合成的遗传密码子如果发生了一个核苷酸突变,结果就能使有关的氨基酸发生变异。
血红蛋白一级分子结构发生变异者最多见于β链,其次是α链,发生在δ链或γ链者很少见,且大多不发生严重后果,故在临床上不甚重要。
珠蛋白链中氨基酸的变异可以有以下多种形式。
(1) 一种珠蛋白链中单一或少数几个氨基酸发生替代。在β链146个氨基酸或α链141个氨基酸中仅有一个氨基酸发生了替代,是异常血红蛋白中最多见的分子异常形式。虽然从一级结构来说变化很小,但有时其后果可以非常严重,例如纯合子的HbS (β6谷→缬),可以发生镰形细胞贫血。一种珠蛋白链中同时可有二个甚至三个氨基酸发生了替代,例如Hb J Singapore(α78天冬→天冬胺;α79丙→甘),Hb Hopkins-2-II(α112组→天冬;α114脯→丝,α113苏→甘),但这种变异非常少见。
(2)一种珠蛋白链中一个或少数几个氨基酸缺失或重复。例如Hb Freiburg (β23缬→0),Hb Lyon (β17-18赖、缬→0),Hb Tochigi(β55-59甘、天冬胺、脯、赖→0),这种变异可引起血红素与珠蛋白解离而使血红蛋白分子不稳定,结果发生溶血性贫血。这类异常血红蛋白常常是不稳定血红蛋白。这种结构的异常可用非同源性基因交换时在一条染色单体上部分基因的缺失来解释。
与基因缺失的情况相反,在珠蛋白链中可以多出几个氨基酸,而这几个氨基酸与前面几个氨基酸是重复的。例如Hb Grady的α118及α119之间嵌入了谷-苯-苏三个氨基酸,而α115-117位置上也是谷-苯-苏三个氨基酸。这种变异也与非同源性基因交换有关,但与上述基因缺失的情况正好相反,在另一条染色单体上增加了三个基因的结果。
(3)珠蛋白链末端的延长。有少数几种异常血红蛋白在正常的α链或β链之后又多出若干个氨基酸,例如Hb Constant Spring、Hb Seal Rock、Hb Icaria、HbKoya Dora等的α链自第1至第141号氨基酸的顺序完全是正常的,但在第141号氨基酸之后各多出31个氨基酸。又如Hb Tak的β链自第1至第146号氨基酸也都是正常的,但在第146号氨基酸之后多出10个氨基酸。对这种变异现认为是因正常末尾氨基酸后的发出停止合成信号的密码子发生了一个核苷酸突变的结果。
另一种氨基酸延长与上述情况略有不同。在珠蛋白链近末端的氨基酸缺掉几个,另再接上若干个氨基酸,超过正常珠蛋白链的长度。这种例子目前有Hb Wayne及Hb Cranston。Hb Wayne的α链在第138号氨基酸之后,最后三个正常的氨基酸缺如,另添上8个氨基酸。HbCranston的β链最后两个正常的氨基酸被另外13个氨基酸所替代。这是因为在开始发生改变的氨基酸的基因中本来正常的密码子中缺失了一个核苷酸,而此后的氨基酸便发生移码的结果。
(4)一条珠蛋白链的两端分属两种不同的珠蛋白链.例如有几种异常血红蛋白的α链都是正常的,而与α链配对的另一珠蛋白链的N端部分与δ链相同,其C端部分与β链相同,这种血红蛋白称为Hb Lepore。与上述情况相反,非α链的N端部分与β链相同,而C端与δ链相同,这种异常血红蛋白称为反Lepore(anti-Lepore)血红蛋白或Miyada型血红蛋白。这种异常血红蛋白的产生是δ和β基因之间交换产生融合基因(或称联接基因)(fusion gene)的结果。这种情况也可发生于γ链和β链。(5) 同一种珠蛋白链的四聚体。HbH是β链的四聚体,HbBart's是γ链的四聚体。这些珠蛋白链本身并无氨基酸顺序的改变。它们出现于a海洋性贫血。其发生原因是因控制α链合成基因的缺失。
异常血红蛋白的分子病理学 珠蛋白链中氨基酸的变异不一定都发生不良的后果,事实上,大多数异常血红蛋白并不发生疾病。但是有一些珠蛋白链分子结构的改变影响了血红蛋白的物理、化学性能及其生理功能,在临床上能发生疾病。
血红蛋白分子表面的氨基酸替代,多数并不产生有害影响,因这些位置上的改变不大影响血红素的功能或亚单位的相互作用。但分子表面的电荷改变可以引起正常的分子间的相互作用。当红细胞内异常血红蛋白的浓度很高时,这种作用便可发生,例如HbS和HbC的纯合子状态。但这种异常血红蛋白的浓度较低时,分子间的相互作用便不发生,因此,HbS和HbC的杂合子状态在临床表现上是隐性的。不过,如果同一人的红细胞中同时既有HbS又有HbC (HbS和HbC的混合或双重杂合子者)时,即使每一种异常血红蛋白的浓度是低的,也能产生严重的临床后果。
有一些血红蛋白的分子结构不稳定,失去血红素连结的血红蛋白在红细胞内易发生沉淀,形成珠蛋白小体,在体外稍微加温(50℃)易发生沉淀。这种异常血红蛋白称为不稳定血红蛋白。这种血红蛋白的形成大多是因血红素囊中非极性(无电荷)的氨基酸被极性氨基酸替代的结果。这种改变能影响血红素与珠蛋白的连结,水可以进入血红素囊,引起血红素与珠蛋白的解离,这种没有血红素的血红蛋白变得很不稳定。有一些不稳定血红蛋白是因珠蛋白链中在某些关键性位置上氨基酸的缺失所引起,使血红蛋白的构形发生改变。例如Hb Gun Hill在β91~β97间可以缺失5个氨基酸,这种变异使血红素与珠蛋白失去了某些重要的连结点,包括近端的组氨酸(β92),以致血红蛋白中的β亚单位中缺失血红素。在螺旋段第三位后的氨基酸如被脯氨酸所替代,这种改变可使珠蛋白链折裂或弯曲,例如Hb Bibba (H19 α136亮→脯),可使血红蛋白分子构形发生改变,而产生不稳定血红蛋白。
珠蛋白链上近端(F8:α87,β92)或远端(E7:α58,β63)的组氨酸如被酪氨酸所替代,所产生的异常血红蛋白称为HbM。这种氨基酸替代能使血红素铁与酪氨酸的苯氧形成离子键,因而将血红素铁固定于Fe3+状态,产生无功能的高铁血红蛋白并发生紫绀。Hb M Milwaukee(E11β67缬→谷)与一般Hb M的变异稍不同,但因血红素铁能与谷氨酸的羧组形成离子键,故亦能产生高铁血红蛋白。
有一些异常血红蛋白与氧的亲和力增强,可引起组织缺氧和继发性红细胞增多症。这一类异常血红蛋白的氨基酸替代大多发生在α1β2接触处,这种改变减少了亚单位间的相互作用,增强了氧的亲和力。氨基酸替代如果发生在α或β链近C端处或2,3DPG与β链结合处,也可发生氧亲和力增强的异常血红蛋白。血红素周围的氨基酸发生变异时,有时也能引起血红蛋白氧亲和力的增强。但这种异常血红蛋白几乎都是不稳定血红蛋白,可发生溶血性贫血或形成高铁血红蛋白而出现紫绀,但不发生红细胞增多症。
少数异常血红蛋白因氧亲和力减低,在组织中氧的释放增多,可产生轻度贫血。Hb Kansas由于氧亲和力过低以致在肺内与氧的结合受到影响,动脉血的氧饱和度降低,因此可发生紫绀。Hb Kansas(G4β102天胺→苏)的氨基酸替代发生在α1β2接触处,同时与血红素也有接触。在正常情况下,此处有一氢键能将血红蛋白二聚体结合在一起,当有上述氨基酸变异时,此氢键不能形成,因此血红蛋白易分裂成二聚体。
归纳上述情况,根据功能方面的改变,异常血红蛋白主要可以分成下列六类(见表)。
临床上能产生疾病的异常血红蛋白目前有下列各种。
在中国(包括台湾省)发现的异常血红蛋白 国内近年来对异常血红蛋白的研究开展较快。截止1980年底,全国17个省、市、自治区进行了异常血红蛋白的普查,在20个民族、123,437人中发现异常血红蛋白317例,发现率为0.26%。1980年以后,许多地区又开展了大量普查,又有不少新的发现。到目前(1984年)经一级结构分析,除了与海洋性贫血有关的HbH、Hb Bart’s以外,已证实有50余种异常血红蛋白(见表3),其中有多种为国外未发现过的新型异常血红蛋白。在海外华侨和华人中发现的异常血红蛋白在国内几乎均已发现。
表1 异 常血红蛋 白 的 功 能 分类
| 血红蛋白功能异常 | 氨基酸变异部位 | 主要临床表现 | 举 例 |
| 无 聚合,溶解度减低 不稳定,溶解度减低 高铁血红蛋白 氧亲和力增强 氧亲和力减弱 | 表 面 表 面 血红素周围非极性氨基酸 近端(F8)或远端(F7)组氨酸 α1β2接触处或βC端 α1β2接触处靠近血红素处 | 无 溶血性贫血(纯合子) 溶血性贫血(杂合子) 紫 绀 红细胞增多症 紫 绀 | HbG Philadelphia HbS Hb Koln HbM Hb Chesapeake Hb Kansas |
表2 临床上能产生疾病的主要异常血红蛋白
| 疾 病 | 异常血红蛋白名称 | 结 构 改 变 | 备 注 |
| 溶血性贫血 | S | A3β3 谷→缬 | 脱氧血红蛋白形成聚合 体,纯合子者发生镰形细胞 贫血 |
(续表)
| 疾 病 | 异常血红蛋白名称 | 结 构 改 变 | 备 注 |
| 溶血性贫血 | C | A3β6 谷→赖 | 溶解度低,纯合子者发生 溶血性贫血 |
| D Punjab E Constant Spring | GH4β121 谷→谷胺 B8β26 谷→赖 α141后还有31个氨基酸 | 纯合子者轻度溶血性贫血 | |
| Leiden Belfast Lyon | A3或A4β6或7谷缺失 A12β15 色→精 A14~15β17~18赖、缬 缺失 | 以下均为不稳定血红蛋 白,在细胞内发生沉淀,形 成包涵体;贫血程度轻重不 一,有些平时无贫血,但感 染时或服药后可发生急性溶 血;Hb Freiburg, Shep- herd’s Bush, Hammers- mith, Seattle等同时产生 高铁血红蛋白,故伴有紫绀; 所见病例均为杂合子者 | |
| Freiburg Riverdale-Bronx Savannah Moscva Volga Geneva Castilla Perth Philly Hammersmith Bucuresti Tochigi | B5β23 缬缺失 B6β24 甘→精 B6β24 甘→缬 B6β24 甘→天冬 B9β27 丙→天冬 B10β28 亮→脯 B14β32 亮→精 B14β32 亮→脯 C1β35 酪→苯丙 CD1β42 苯丙→丝 CD1β42 苯丙→亮 D7,E1, E2 E3 β56~59甘、天胺、脯、赖 缺失 | ||
| Zurich Bristol Sydney Seattle Christchurch Shepherd’s Bush Bush Wick Atlanta Bryn Mawr Santa Ana Boras Sabine New Castle Istanbul Gun Hill | E7β63 组→精 E11β67 缬→天冬 E11β67 缬→丙 E14β70 丙→天冬 E15β71 苯丙→丝 E18β74 甘→天冬 E18β74 甘→缬 E19β75 亮→脯 F1β85 苯丙→丝 F4β88 亮→脯 F4β88 亮→精 F7β91 亮→脯 F8β92 组→脯 F8β92 组→谷胺 F7~FG2或F9~FG4 β91~95或92~96或 93 97毫、半胱、天、组 缺失 | ||
| Koln Nottingham Rush Southam pton Peterborough Madrid Wien Olmsted Torino | FG5β98 缬→甲硫 FG5β98 缬→甘 G3β101 谷→谷胺 G8β106 亮→脯 G13β111 缬→苯丙 G17β115 丙→脯 H8β130 酪→天冬 H19β141 亮→精 CD1α43 苯丙→缬 |
(续表)
| 疾 病 | 异常血红蛋白名称 | 结 构 改 变 | 备 注 |
| 溶血性贫血 | Hirosaki Ann Arbor Bibba | CD1α43 苯丙→亮 F1α80 亮→精 H19α136 亮→脯 | |
| H | α2β2→β4 | 出现于α海洋性贫血,某 些药物能加速溶血 | |
| HbM产生的紫绀 | M Boston M Iwate M Saskatoon M Hyde Park M Milwaukee | E7α58 组→酪 F8α87 组→酪 E7β63 组→酪 F8β92 组→酪 E11β67 缬→谷 | 杂合子者有紫绀,M Sa- katoon及M Hyde Park 伴有轻度溶血性贫血 |
| 脱氧血红蛋白产生的紫绀 | Kansas | G4β102 天胺→苏 | 血红蛋白氧亲和力过低, 杂合子者有紫绀 |
| 红细胞增多症 | Chesapeake Olympia Helsinki Rahere Malmo Wood Yakima Kempesey Yesilanti Radcliffe Brigham Heathrow San Diego Andrew Minneapolis Rainier Bethescla Hiroshima | FGα92 精→亮 B2β20 缬→甲硫 EF6β82 赖→甲硫 EF6β82 赖→苏 FG4β97 组→谷胺 FG4β97 组→亮 G1β99 天冬→组 G1β99 天冬→冬胺 G1β99 天冬→酪 G1β99 天冬→丙 G2β100 脯→亮 G5β103 苯丙→亮 G11β109 缬→甲硫 HC1β144 赖→冬胺 HC2β145 酪→半胱 HC2β145 酪→组 HC3β146 组→天冬 | 血红蛋白氧亲和力增高 阻碍氧在组织中的释放 在杂合子者中引起代偿性 红细胞增多症 |
| 胎儿水肿综合征 | Bart’s | α2γ2→γ4 | 氧亲和力高的不稳定血红 蛋白;纯合子者引起胎儿窒 息而死 |
表3 中国已发现的部分异常血红蛋白
| 血红蛋白名称 | 珠蛋白链及 氨基酸序号 | 变 异 | 发现地区 | 民 族 |
| Wenchang-Wuming(文昌-武鸣) J Oxford Beijing I Handsworth Zizong(资中) Shuangfong(双峰) G Hong Kong Queen Montgomery Russ | α11 α16 α16 α16 α18 α19 α27 α30 α34 α48 α51 | 赖→谷胺 甘→天冬 赖→天胺 赖→谷胺 甘→精 丙→谷 谷→赖 谷→谷胺 亮→精 亮→精 甘→精 | 广东、广西 广西 河南,湖北 广西、贵州 广西 四川 湖南 广东、四川 安徽、江苏、黑龙江 黑龙江 广东 | 汉、壮 汉 汉 汉、壮 壮 汉 汉 汉 汉、朝 朝 汉 |
(续表)
| 血红蛋白名称 | 珠蛋白链及 氨基酸序号 | 变 异 | 发现地区 | 民 族 |
| U be G Taichung(台中) Duan(都安) Stanleyville M Iwate G Guangzhou(广州) S Leiden J Luhe(六合) Ankara G Coushatta | α68 α74 α75 α87 α87 α117 β4 β6或7 β8 β10 β22 | 天冬胺→天冬 天冬→组 天冬→丙 天冬→赖 组→酪 苯丙→甘 谷→缬 谷→0 赖→谷胺 丙→天冬 谷→丙 | 广东 台湾、广东、广西、江西 广西、贵州 广东、广西、江西 上海 广东 广东 江西 江苏 云南 台湾、河北、河南、江西、广 西、广东、湖北、四川、陕 西、青海、黑龙江 | 汉 汉、壮 壮、布依 汉 汉 汉 汉(混血) 汉 汉 汉 汉、回 |
| G Taipei(台北) | β22 | 谷→甘 | 台湾、贵州、广西、湖北、江 西、四川、江苏、湖南、山 西 | 汉、水 |
| Taiwan-Ami(台湾亚美) E | β25 β26 | 谷→精 谷→赖 | 台湾 广东、广西、贵州、云南、四 川、湖南、湖北、江苏、安 徽、福建、河北、甘肃、内 蒙、江西、山西、河南 | 亚美 汉、苗、壮、京、蒙、瑶 |
| Lufkin Willamette J Bangkok | β29 β51 β56 | 甘→天冬 脯→精 甘→天冬 | 河南 广西 广西、湖南、四川、山西、陕 西、福建、贵州、台湾 | 汉 壮 汉 |
| Hamadan J Lome J Kaohsiung(高雄) | β56 β59 β59 | 甘→精 赖→天冬胺 赖→苏 | 山西 广西、甘肃 台湾 | 汉 汉、彝 |
| J Calabria Qionghai(琼海) G Hsi-Tsou | β64 β78 β79 | 甘→天冬 亮→精 天冬→甘 | 广西 广东 台湾 | 壮 汉 |
| G Szuhu(四湖) Ta-Li | β80 β83 | 天冬胺→赖 甘→半胱 | 台湾、四川 台湾 | 汉 |
| M Hyde Park New York | β92 β113 | 组→酪 缬→谷 | 山东 广东、广西、湖南、江西、台 湾 | 汉 汉、京 |
| D Punjab | β121 | 谷→谷胺 | 内蒙、新疆、青海、蒙、汉、河 南、河北 | |
| J Taichung(台中) | β127 | 丙→天冬 | 台湾 |
异常血红蛋白的检验 血红蛋白电泳是检验各种异常血红蛋白最常用的方法。已发现的各种异常血红蛋白大多是在常用的电泳条件下,因其电泳速度与正常血红蛋白不同而被发现的。但有不少种异常血红蛋白的珠蛋白变异对分子总的电荷并无改变或极少改变,这种异常血红蛋白电泳时与HbA的速度相同或几乎相同,因此,这种异常血红蛋白不能依靠普通条件下的电泳法查出,但是有时改用不同条件的电泳法可将这些异常血红蛋白与正常血红蛋白区别。例如用pH8.6~8.8缓冲液,HbM与HbA难以分离,但在pH7.0的条件下可以分离;在pH8.6~8.8的条件下,HbE与Hb A2泳速相同,但如改用pH6.8的缓冲液,两者即能分离。此外,许多种异常血红蛋白的电泳特点相同,因此用电泳技术不能彼此区别。例如HbS与HbD的电泳速度相同,在HbG位置上的异常血红蛋白已发现有十余种之多。这些异常血红蛋白常需依靠其他的检验方法加以区别。近年发展起来的等电聚焦技术(isoelectric focusing)对异常血红蛋白能作出更精细的分析,各种血红蛋白的等电点只要超过0.02pH单位,即可彼此分离。在临床工作中,操作简易的热变性试验(亦称热不稳定试验),可用以检出不稳定血红蛋白。有氧亲和力改变的异常血红蛋白常需测定红细胞或血红蛋白的氧亲和力,方能作出诊断。HbM的鉴定可采用吸收光谱的分析。
为了鉴定异常血红蛋白中那一对珠蛋白链的氨基酸顺序异常,可用人和狗的血红蛋白混合后作珠蛋白链杂交试验。但如果需要准确鉴定某一种异常血红蛋白,特别在可能发现一种新的异常血红蛋白时,必须指出氨基酸顺序的变异究竟发生在那一珠蛋白链的那一个位置上,是怎样的改变,这就必须依靠复杂的肽链分析技术。进行肽链分析,通常首先用胰蛋白酶使肽链断裂成若干肽。正常的α链断裂成14个肽段,β链15个。然后将这些肽段的混合物置于滤纸上向一个方向作高电压电泳,再向另一个方向作层析。这样可使所有的肽段在滤纸上分散,各有一独特的固定位置,经茚三酮染色后,各肽段可以清楚地看出。这一图象称为“指纹图”(“finge-rprint”)或肽图。肽段的位置如有改变,说明此肽段的氨基酸顺序有异常。断裂珠蛋白链成肽亦可用自动柱状层析仪。不管用那一种方法,如果发现有异常的肽段,可将此肽段洗脱或收集起来,进行化学分析,以测定其氨基酸顺序。这种分析方法只有在有专门设备和技术的研究实验室中方能进行。
- 祛瘀活血是什么意思
- 祛瘀活血法是什么意思
- 祛瘀消肿是什么意思
- 祛瘀消肿膏是什么意思
- 祛瘀生新是什么意思
- 祛瘀调经汤是什么意思
- 祛瘀通络是什么意思
- 祛瘀降糖方是什么意思
- 祛瘴辟瘟丹是什么意思
- 祛癫汤是什么意思
- 祛盗是什么意思
- 祛祛是什么意思
- 祛祸作福是什么意思
- 祛禳是什么意思
- 祛累是什么意思
- 祛腐生肌灵油膏是什么意思
- 祛臭食品是什么意思
- 祛蠹是什么意思
- 祛蠹除奸是什么意思
- 祛衣受业是什么意思
- 祛衣请业是什么意思
- 祛袂是什么意思
- 祛褪是什么意思
- 祛退是什么意思
- 祛邪是什么意思
- 祛邪守灵丹是什么意思
- 祛邪扶正是什么意思
- 祛邪法是什么意思
- 祛邪消灾是什么意思
- 祛降是什么意思
- 祛除是什么意思
- 祛除恶气是什么意思
- 祛除杂念,使心神凝寂是什么意思
- 祛除瘟病是什么意思
- 祛除邪魔是什么意思
- 祛隆八味石榴散是什么意思
- 祛风是什么意思
- 祛风丸是什么意思
- 祛风养血是什么意思
- 祛风利湿是什么意思
- 祛风化痰是什么意思
- 祛风去湿是什么意思
- 祛风地黄丸是什么意思
- 祛风定志汤是什么意思
- 祛风定惊是什么意思
- 祛风宣肺是什么意思
- 祛风导痰汤是什么意思
- 祛风换肌丸是什么意思
- 祛风散是什么意思
- 祛风散寒是什么意思
- 祛风明目是什么意思
- 祛风止痒是什么意思
- 祛风止痒汤是什么意思
- 祛风止痛药是什么意思
- 祛风法是什么意思
- 祛风活络膏是什么意思
- 祛风活血是什么意思
- 祛风消疹方是什么意思
- 祛风润面散是什么意思
- 祛风清上散是什么意思