层析法chromatography
利用物质在固定相和流动相之间分配或吸附能力的差异进行分离、纯化的技术。固定相可以是固体、液体或固液混合物;流动相可以是液体或气体,流经或穿过固定相。根据被分离的化合物的分配系数或吸附能力来选择适当的固定相和流动相。由于固定相和流动相所处的状态可分为液相层析和气相层析,按层析过程的原理分类则有吸附层析、分配层析、离子交换层析、凝胶层析。按操作形式不同又可分为薄层层析、纸层析和柱层析。有时为了纯化一种化合物往往可以相继使用几种层析方法。
层析法
又称“色谱法”。近代生物化学最常见的分析方法之一。利用混合物中各组分物理化学性质的差别,使各组分在流动相和固定相之间反复分配,从而使复杂的混合物中各组分得到分离。
层析法
即色谱法。
层析法
层析法是一类可以分离和鉴定混合物中组分的技术。层析法利用的是组分间的理化性质,如溶解度、吸附力、分子形状和大小等的差别。在层析中,样品溶液加在固定相中。固定相可以是固体,也可以是液体,但固定相的液体一定要载在惰性的支持物上(或称载体)、样品加在固定相之后就用含一定组成的液体通过固定相,流动的液体是展开剂或流动相。样品(溶质)随流动相(溶媒)移动,不同组分由于理化性质不同而移动有快慢之分,由此就可达到分离目的。再者某些物质在一定条件下移动距离与流动相移动距离之比为一常值,以Rf值表示,即: 若要收集层析中的溶质,可用流动相不断通过整个固定相,直至所需溶质被带下。这就是洗脱,洗脱下来的移动相是洗脱液。固定相装在直立的圆柱内就是柱层析;若固定相平铺展开在平板上就是薄层层析,纸层析也属此。层析法按其原理可分为吸附层析、亲和层析、分配层析、凝胶层析、离子交换层析等。
若要收集层析中的溶质,可用流动相不断通过整个固定相,直至所需溶质被带下。这就是洗脱,洗脱下来的移动相是洗脱液。固定相装在直立的圆柱内就是柱层析;若固定相平铺展开在平板上就是薄层层析,纸层析也属此。层析法按其原理可分为吸附层析、亲和层析、分配层析、凝胶层析、离子交换层析等。
吸附层析 吸附层析是根据固定相对各组分吸附作用的不同而分离组分的。例如氧化铝或硅胶具有吸附一些物质的性质,但它们对不同物质具有不同的吸附力,这种差别就可将混合物分离开。作为吸附剂的固定相装在玻璃管中即成柱层析。管下端铺玻璃棉之类物质,管内加吸附剂,经溶剂润湿后即成吸附柱。若在柱顶部加上含组分A和B的样品,它们就被吸附在柱的上端,及至样品溶液全部进入吸附柱后,用适合的溶剂(流动相)洗脱,A与B也就按其被吸附的强弱而随流动相以或慢或快的速率向下流动,最后即可使A与B分离开来。在洗脱过程中,样品在柱中不断发生溶解、吸附、再溶解、再吸附的过程。例如,被吸附的A组分和B组分被洗脱液溶解并随之下移,但遇到新的吸附剂,A和B又被吸附,新溶剂再把它们溶解; 实际上是无限次的溶解-吸附过程。最后由于吸附剂和溶剂对A和B的吸附力与溶解力不相同,从而在柱上A与B移动的距离也不一,并在柱上形成两个环带,分别为A和B两物质。如它们是有色物质就可直接看出来,如最早用吸附层析分离胡萝卜素这例子。如无色也可用试剂使之显色,可将吸附柱完整从管中取出,分段切开,去作鉴定。更常是用溶剂洗脱之,连续分段收集洗脱剂,再去作鉴定或其他检查。
薄层层析 是将吸附剂在玻璃板上均匀铺成薄层,样品点在薄层一端,再用溶剂展开以达到分离目的。此法具有设备简单、操作容易、层析时间短(仅几分钟到几小时)、不受温度影响、显色方便而且分离效率也高。薄层板制备方法有两种:
❶将吸附剂如氧化铝、硅胶等直接均匀铺在玻板上,不加粘合剂,制作简便,但易被弄散;
❷加水或其他液体作为粘合剂把吸附剂调制成糊再铺板,待干燥后使用,制备也不太难,且便于保存,常用氧化铝G(G指含5%煅石膏)或硅胶G制板,也可用淀粉或羟甲基纤维素作粘合剂。通常非极性的或极性不强的有机物如磷脂、胆固醇、甘油酯、胡萝卜素之类物质最适用吸附层析分离。
亲和层析 这是根据生物高分子能与相应的配基专一可逆结合的原理来分离纯化的技术。因为是利用高分子最独特和专一的性质即它们的生物功能,所以这种技术的提纯效果远比其他层析法或其他纯化高分子的方法好得多。通常一步提纯分离就可纯化100~1000倍,且收获率高、操作简便,分离也快。这种七十年代才发展的技术现已对生物化学作出很大贡献。它主要用来分离纯化如酶、受体、抗原或抗体等蛋白质,因为它们有适当的配基来进行可逆结合。这方法的基本原理是将要分离纯化的蛋白质的特异配基L牢固结合到一种不溶的支持体M上,产生吸附剂M—L。把吸附剂置于柱中,将含要分离纯化的蛋白质P的混合液使之通过这个亲和层析柱,蛋白质P由于与吸附剂非共价结合而阻滞在柱中,M—L+P⇌M—L…P如混合中除蛋白质P外其他蛋白质均不与配基结合,则这些蛋白质就通过了柱。在彻底洗脱层析柱后再用可使结合在柱上的蛋白质解离的溶剂洗脱,即使上式平衡左移,就可收集到纯化的蛋白质P。
亲和层析所用配基有酶的作用物的类似物、效应物、辅助因子及抗原或抗体等。配基要与所分离蛋白质有强的亲和力,解离常数要小于5mmol为宜,但也不宜太强以致洗脱条件过强而引起蛋白质变性。配基还要有与支持物共价结合的基团。所用支持物(载体)也应具备一定特性:
❶化学惰性: 使非特异的吸附尽量小;
❷具有相当量的化学基团可与配基共价结合;
❸较好的理化稳定性,能经受结合配基和作层析时的各种影响;
❹具有能被亲和吸附的大分子自由通过的多孔网状结构;
❺良好的机械性能,颗粒均匀,使亲和层析柱有高的流速。常用的载体有琼脂糖凝胶、聚丙烯酰胺凝胶及多孔玻璃珠等。将配体共价结合到载体上的方法有多种。通常先活化
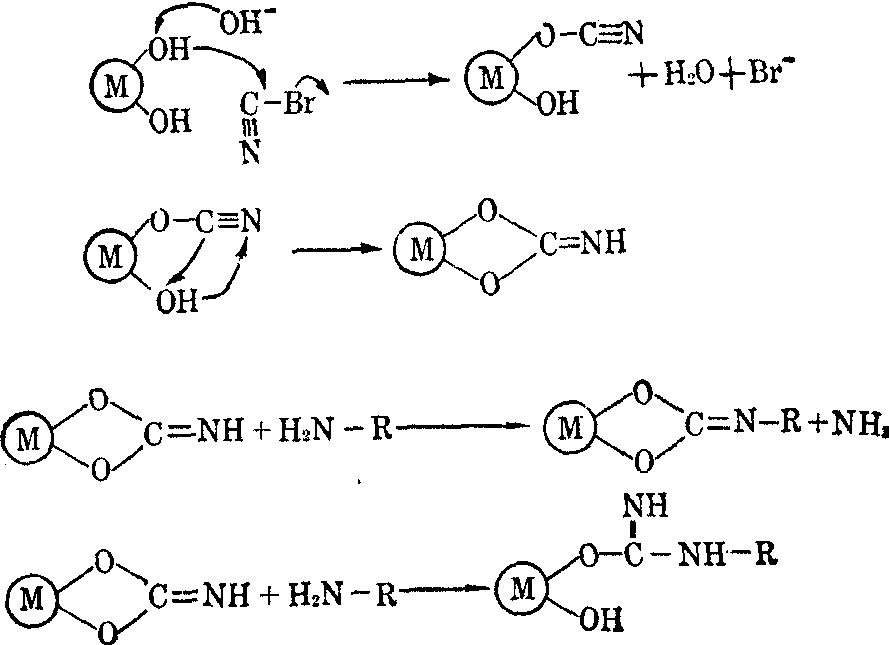
层析柱上样品后,柱中配基与样品中要分离的蛋白质结合成为复合物,随着样品的不断加入,形成的复合物增多。所用平衡缓冲液,其组成、pH及离子强度要选用最利于形成复合物者。用平衡缓冲液充分流洗,除去非特异吸附的杂质而留下特异的蛋白质,这时可把特异的蛋白质洗脱下,洗脱时可用改变了pH或离子强度或两者都改变了的缓冲液; 也可加入可溶性配基作竞争性洗脱; 还可试用蛋白质变性剂如尿素、盐酸胍等洗脱。
分配层析 分配层析利用混合物各组分在两种或多种不同溶剂的分配系数不同而将它们分离开,相当连续的溶剂萃提。如以含水的载体作为固定相,以与水不相混合或仅部分混合的溶剂为流动相,则混合物各组分因它们在这两相中的分配系数不同而被分开形成层析谱,载体是一些吸附力小、反应性弱的惰性物质,如纤维素粉、淀粉、滤纸等。载体在分配层析中只起承载固定相的作用。除上面提到的水外,诸如稀硫酸、甲醇、仲酰胺等强极性溶液也可作固定相。流动相则用比固定相极性小或非极性的有机溶剂。
最普通的应用最广的分配层析就是纸层析。滤纸含水约20~22%,水就是通常的固定相。要分离的样品点在纸的一端,然后以某些醇、酚等溶剂作为流动相进行展开。当有机溶剂流动相流经样品点时,层析点上溶质遂在水相和有机相之间进行分配,有一部分溶质离开原点随移动相移动进入无溶质处,又再进行分配,一部分溶质从移动相(有机溶剂)进到固定相(水)中。移动相不断流动,溶质也就不断在两相间分配,沿移动相方向移动。溶质中各组分由于分配系数不同,就逐渐在纸上集中在不同的位置。分配于固定相的趋势大的组分则随流动相走的速度慢; 分配于流动相的倾向大的组分,随流动相走得快。物质在一定溶剂对中的分配系数是个常数,所以它在纸上移动速率以Rf表示也是恒定的; 因而Rf值可用来作鉴定一种物质的一个指标。
纸层析 可分为垂直型和水平型。前者将滤纸悬起或垂直放置,流动相向上(籍毛细管作用)或向下扩散。后者是水平放置的圆型滤纸,溶剂经圆心的蕊向四周扩散。垂直型应用多。用一种溶剂系统进行一次展开是单向层析; 若样品组分较多,有Rf值相近的,则单向层析不能将所有组分分离开,可采用双向层析法。即在方型滤纸一角上样,先用第一种溶剂系统展开,展开完后吹干并除去第一种系统溶剂,将滤纸转90°后用另一种溶剂系统展开;这第二次展开可将第一次展开未能分离开的组分在此时可被分开。纸层析可用于分离氨基酸、糖、脂类、核苷酸等物质。
凝胶层析 又称排阻层析或分子筛层析。当柱层析以凝胶颗粒为固定相时,样品中分子较小的组分可进入凝胶的多孔网状结构内,从而洗脱较慢,而样品中分子较大的组分不能进入凝胶的多孔网状结构内,亦即被排阻在凝胶之外,从而洗脱得快。这就籍凝胶的过滤作用而完成分离过程。因而凝胶过滤中,被保留下的是小分子而不是大分子,亦即洗脱时先下来的是大分子,然后才是小分子。
分子筛层析常用凝胶有葡聚糖、琼脂糖和聚丙烯酰胺。葡聚糖凝胶可由葡聚糖与表氯醇反应而成。调节葡聚糖的分子量和浓度以及表氯醇的浓度就可以产生孔径等性质不同的凝胶。葡聚糖凝胶型号以G10、G50等表示,其数值是该型号凝胶含水值 (每克干凝胶含水的毫升数)乘10。琼脂糖凝胶和聚丙烯酰胺凝胶参见 “电泳法”条。除了凝胶的孔径外,凝胶的粒度也影响分离的效果。粒度越小,分辨力越大,这是由于凝胶表面积增加,使分子有更多的被排阻机会。然而这种分辨力的增加伴同小粒度层析柱流速降低,通常分析工作以100~200目就可,为更精细的分辨,可采用200~400目,做制备工作50~100目即可。
凝胶过滤的优点: 凝胶过滤通常只需用一种洗脱液,不必更换洗脱液。层析柱装好后可反复多次使用,每次洗脱过程本身就是再生过程,可以连续使用,无须回收处理,因而简便、快速又经济。重复性好,样品回收几达百分之百,也利于作大量的分离纯化。这方法极温和,不易使生物高分子变性失活。凝胶过滤分离范围,从分子量102~108;常用凝胶的分离范围如下表:凝胶过滤广泛应用于分离纯化蛋白质、酶、核酸等生物高分子; 还可用来测定蛋白质的分子量。用凝胶过滤法测分子量方法简单易掌握、样品用量少且不必要纯品。但此法测得结果尚要与他法结果参照方可。
凝胶分离范围
| 凝 胶 | 分子量范围 |
| 葡聚糖(Sephadex) | |
| G10 G25 G50 G100 G200 | -700 1000~5000 1500~30 000 4000~150 000 5000~800 000 |
| 琼脂糖(Sepharose) | |
| 4B 2B | 0.3×106~3×106 2×106~25×106 |
| 聚丙烯酰胺 | |
| P6 P60 P100 P200 | 1000~5000 30 000~70 000 40 000~100 000 80 000~300 000 |
离子交换层析 这种层析利用离子交换剂对被分离的各种离子状态的物质有不同的亲和力而达到分离目的。离子交换剂是在不溶性高分子载体上引入活性的基团而成,这些基团能与水溶液中阴离子或阳离子进行交换。溶液中离子穿过交换剂表面进入颗粒内与交换剂的离子交换。因为交换是定量完成的,所以测定溶液中由固定相上交换下来的离子量就可知样品中离子的含量,也可用另一种洗脱液将交换在固定相上的样品离子洗脱下来进行测定。当多种离子成分被交换到固定相上,用洗脱剂洗脱时亲和力(静电引力)弱的离子先被洗下来,亲和力强的离子移动慢,后被洗脱下。作为活性基团载体的有合成树脂、纤维素和葡聚糖等。离子交换剂分为两大类: 具有酸性基团,能交换阳离子的阳离子交换剂和具有碱性基团,能交换阴离子的阴离子交换剂。按基团解离性的大小又可分为强型和弱型。阳离子交换剂以磺酸基 (—SO3H)、磷酸基 (—PO3H2) 者为强型,以羧基(—COOH)、酚羟基(—OH)者为弱型。以季胺基(—N+(CH3)3)者为强型阴离子交换剂,而以伯胺基(—NH2)、仲胺基(—NHCH3)和叔胺基 (—N(CH3)3)者为弱型阴离子交换剂。常用的是以树脂或纤维素做交换基团载体。交换的反应为:
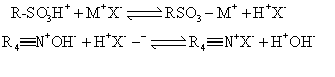
虽然交换反应都是平衡反应,但在层析时由于连续加入新的交换溶液,平衡按正反应进行。
离子交换层析广泛应用于分离生物物质。主要用于氨基酸的分析; 氨基酸分析仪就是由离子交换层析柱和相应的其他设备所组成的自动化的离子交换层析。
- 讨伐擒获是什么意思
- 讨伐敌人是什么意思
- 讨伐敌寇是什么意思
- 讨伐暴乱者是什么意思
- 讨伐有罪者是什么意思
- 讨伐消灭是什么意思
- 讨伐消灭凶恶叛逆的人是什么意思
- 讨伐程度是什么意思
- 讨伐绥靖是什么意思
- 讨伐者声威强大,不战而降服对方是什么意思
- 讨伐芟除是什么意思
- 讨伐董卓是什么意思
- 讨伐西羌是什么意思
- 讨伐贼寇是什么意思
- 讨伐,攻击是什么意思
- 讨佬𡚸是什么意思
- 讨侬嫌是什么意思
- 讨便宜是什么意思
- 讨便宜即是吃亏的后门是什么意思
- 讨便宜处失便宜是什么意思
- 讨俏是什么意思
- 讨保是什么意思
- 讨保释放是什么意思
- 讨信是什么意思
- 讨俺娘是什么意思
- 讨倒转来是什么意思
- 讨债是什么意思
- 讨债仔是什么意思
- 讨债佬是什么意思
- 讨债公司是什么意思
- 讨债囝是什么意思
- 讨债块是什么意思
- 讨债用是什么意思
- 讨债趣对是什么意思
- 讨债鬼是什么意思
- 讨公道是什么意思
- 讨冷饭吃是什么意思
- 讨击是什么意思
- 讨击使是什么意思
- 讨分上是什么意思
- 讨分晓是什么意思
- 讨删是什么意思
- 讨力是什么意思
- 讨功是什么意思
- 讨功念劳是什么意思
- 讨劳碌是什么意思
- 讨势是什么意思
- 讨卵嫌是什么意思
- 讨厌是什么意思
- 讨厌包是什么意思
- 讨厌和尚恨袈裟是什么意思
- 讨厌的酸味是什么意思
- 讨厌的错误是什么意思
- 讨厌着贺呢是什么意思
- 讨厌鬼是什么意思
- 讨厌,憎恨是什么意思
- 讨厌,憎恶是什么意思
- 讨原是什么意思
- 讨取是什么意思
- 讨取食物是什么意思