小儿肝脏解剖与生理特点
小儿肝脏解剖与生理特点分胚胎发育、生理特点、肝细胞超微结构和功能及检查特点四方面阐明。
肝脏胚胎发育 胚胎早期,肝由前肠套入横隔的中胚层而形成,胆管及肝细胞则由内胚层衍化而成。中胚层形成髓质、内皮细胞、枯否细胞、纤维组织及血管。胚胎10mm时,门静脉及肝静脉的所有分支已很明显。从胎盘来的大部分脐静脉血经静脉导管至下腔静脉,余者经门静脉入肝、再经肝静脉,进入下腔静脉。在此时期,肝左右二叶大小相等,但以后因门静脉血引流至左叶不如右叶,使左叶发育相对缓慢致在出生时左叶小于右叶。静脉导管一般于出生后即呈功能性关闭,生后10~20天完全关闭。
胚胎后期肝细胞形态已与成人相似,但呈2个细胞厚度的重叠排列,影响运送物质出入肝细胞的效能; 2岁开始,至5岁时全部肝单位由单一细胞组成。
肝脏生理特点
肝脏对糖、蛋白质及脂类等营养物质的代谢起重要作用,对很多内生及外生物质包括胆红素等的转化也起代谢或解毒作用。肝脏也是胆汁形成、糖原及一些脂溶性维生素如维生素A、D、E、K及维生素B12的储存场所。这些功能于新生儿期可有暂时性不足,尤以早产儿更为显著。胎儿期,胎盘及母体组织负担着肝功能的作用,此时许多对体内平衡起作用的肝酶均无显著活性。发育过程中肝的主要生理作用,简述于下:
(1) 糖代谢: 食物中的单糖类、葡萄糖、半乳糖及果糖从肠道吸收后被肝脏所摄取,被立即结合于三羧酸循环中作为热能而加以利用,也可转化成糖原。肝糖原为糖用之不竭的来源,饥饿时可释放葡萄糖以维持血糖浓度 (肌糖原并不释放葡萄糖进入全身血循环)。胚胎末期,胎儿肝内已有大量糖原,但早产儿或低出生体重儿贮存较少,出生后糖原迅速被动用,故易发生低糖血症,可能由于糖原异生作用差,不能补充肝糖原之故。
(2) 脂肪、类固醇、胆盐代谢: 从小肠吸收的天然脂肪在肝内氧化成甘油和游离脂酸,脂酸再氧化成乙酰辅酶A而进入三羧酸循环。甘油被利用形成其他三酸甘油或通过乙酰辅酶A降解。磷脂、鞘磷脂及类固醇亦在肝内合成。
肝参与性激素、糖皮质激素类及盐皮质激素类代谢,其主要步骤为产生无活性代谢产物与葡萄糖醛酸或硫酸盐结合后,由肾经尿排出。
肝、肠粘膜、肾上腺皮质及动脉壁内合成胆固醇,以中性固醇形式在胆汁内排泄,也为提供固醇类激素的基本结构。胆固醇为胆盐的前体。新生儿血清中胆酸及胆固醇浓度低于较大儿童及成人,其胆酸合成减少,即使按体表面积纠正后,新生儿期胆酸的量仍比成人少,故即使胆酸转运无缺陷,脂肪吸收仍差。这些生理缺陷于出生时曾接受地塞米松预防新生儿肺透明膜病的婴儿则不能见到,可能地塞米松能诱导胆酸形成。
(3) 蛋白质及氨基酸代谢: 氨基酸由肠吸收后迅速被肝处理,在肝内脱氨基、转氨基或于蛋白质合成中被利用。氨基酸脱氨作用产生的氨迅速转化为尿素。
血浆中除免疫球蛋白外大部分蛋白质由肝细胞的粗面内质网合成,白蛋白量最多,但结合珠蛋白、转铁蛋白、铜蓝蛋白、C反应蛋白、α1-抗胰蛋白酶、α2球蛋白及α、β脂蛋白等也于肝内合成。
其他涉及凝血机制的重要蛋白质如纤维蛋白原、凝血酶原及Ⅴ、Ⅶ、Ⅸ、Ⅹ及部分Ⅷ因子均于肝内形成,第Ⅱ、Ⅶ、Ⅸ、Ⅹ因子的合成需依赖维生素K。凝血系统的抑制剂如抗凝血酶及纤溶系统的前纤维蛋白溶酶亦于肝细胞内合成。
胎儿期及新生儿期蛋白质合成活跃,胎儿期主要血清蛋白为甲胎蛋白,即α1球蛋白,最初见于6周胎儿的血清中,胎儿至13周时达高峰浓度300mg/dl,以后渐下降至脐血中约7mg/dl。生后6周血浓度可低于0.0025mg/dl。白蛋白合成始于胚胎3~4个月时,出生时血清浓度相当于成人水平,早产儿则较低。与凝血有关的蛋白于胎儿娩出时浓度低,但数日内即升至正常水平。血浆铜蓝蛋白出生时低,3个月时达最高浓度,以后缓慢下降,至2岁时为成人水平。故各种蛋白质值达到体内稳定的时间并不一致。新生儿阻塞性肝病时,甲胎蛋白的生成继续进行而不减低;40~50%的肝细胞肿瘤患者也同样能生成较多的甲胎蛋白。
胎儿血内氨基酸浓度除胱氨酸外均比成人高,但于出生前后影响氨基酸代谢或降解的酶活性较低,早产儿苯丙氨酸值常增高,即由于降解该氨基酸的酶缺乏所致。早产儿如摄入蛋白过高,可由于代谢缺陷,使血清氨基酸浓度增高而致病。
(4) 药物代谢: 药物于肝内代谢有两步骤: 第一步为去甲基,氧化或还原作用的生化转变。后与硫酸盐或葡萄糖醛酸化合物结合成更为水溶性的化合物,使之易于从尿或胆汁中排出。持续服用苯巴比妥、苯妥英钠或利福平等,可升高药物代谢作用中所需酶的浓度及活性。此“酶诱导”的过程并非特异性,一种药物可诱导对其他药物有作用之酶增加,并可使内生物质如类固醇代谢增加,如应用苯巴比妥由于诱导肝脏微粒体的羟化酶增加,而使维生素D于肝内的代谢加强和紊乱,故易发生佝偻病。
出生后2~4周时的药物代谢与成人有较大差异,因各种药物与血清蛋白结合的能力及在肝内代谢途径各有不同以及肾功能不足所致。新生儿期对药物代谢的不利情况与对胆红素代谢情况相仿,故新生儿期药物的药理作用及半衰期均有特异性,一般给药时剂量宜小,次数减少。
(5) 网状内皮系统功能: 胎儿期肝为造血的重要器官,胎儿7个月时造血功能最强,出生6周后正常造血限于骨髓,但于溶血性贫血或骨髓腔被破坏时肝网状内皮细胞又能形成血红素而恢复造血功能。枯否细胞的吞噬作用,于去除各种细菌、产物(如内毒素)、及其他吸收入门脉血的抗原中起重要作用,该细胞可能与其余的网状内皮系统一样于产生抗体方面起着重要作用。
肝细胞超微结构及功能 近代通过电子显微镜,细胞组织化学、生物化学和细胞化学分离技术联合研究,对肝细胞内部的微细结构(细胞器见图)和功能有较深的了解。各细胞器的功能简述如下:
(1) 浆膜: 有三个面,各具有不同形态和不同的酶活性,
❶血窦面,含碱性磷酸酶及核苷酶-单磷酸酶,是酶活动和细胞内外物质交换场所 (脂肪、糖、氨基酸入内,胆固醇、白蛋白和纤维蛋白原外出),
❷胆小管面,含水解酶,主要功能为分泌及排泄胆汁,
❸浆膜紧贴面,把血液和胆汁分隔,不致混淆。
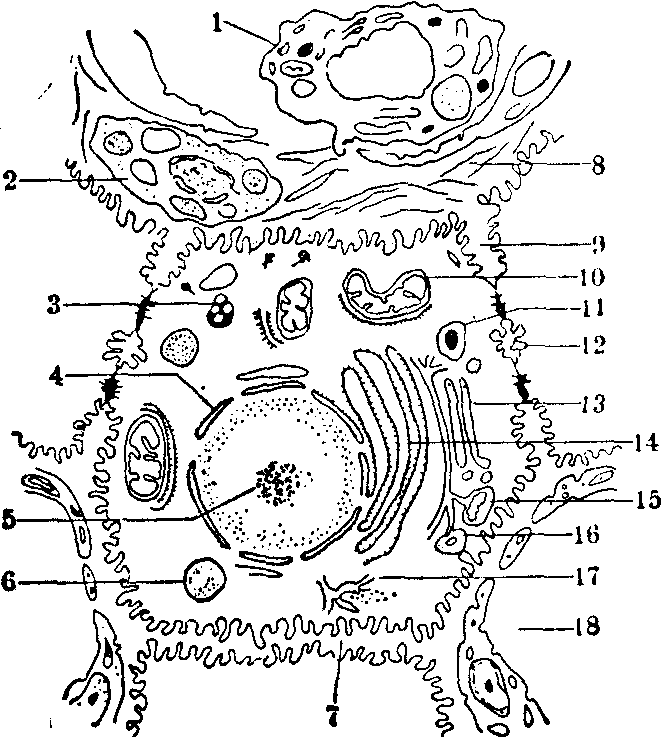
肝细胞超微结构
1. 枯否细胞 2. 贮脂细胞 3. 脂褐质色素颗粒4. 细胞核 5. 核仁 6. 脂质 7. 细胞间通道8. 窦周间隙内胶原纤维 9. 细胞间陷窝 10. 线粒体 11. 微粒体 12. 胆小管 13. 高尔基体14. 内质网 15. 自身吞噬细胞 16. 致密体质网 15. 自身吞噬细胞 16. 致密体17. 肝糖原 18. 窦状隙
(2) 细胞核: 为调节遗传特性的主要部位。
(3) 内质网: 分粗面和光面两种。含有各种酶类,参与蛋白质、脂肪、糖(包括粘多糖)和血红素的合成及转送,也是胆红素、激素、药物等代谢的主要场所。如缺乏葡萄糖-6-磷酸脱氢酶可致Ⅰ型糖原代谢病。
(4) 高尔基体: 参与多糖、糖蛋白、糖脂蛋白的合成、蛋白质及脂类的结合。
(5) 溶酶体: 含30种酸性水解酶,能分解衰老细胞器及其代谢产物,缺乏时发生相应的代谢紊乱病 (如Ⅱ型糖原代谢病)。
(6) 线粒体: 含大量水解酶和辅酶,参与三羧酸循环和氧化磷酸化过程及脂类代谢。多种营养物质的转化、能量(如ATP)的贮存、丙酮酸的糖原异生作用和卟啉合成的催化作用均子线粒体内进行,线粒体为细胞损害的敏感指示器。
(7) 过氧化酶体: 又称微粒体含四种氧化酶,能相互合成和催化氧化作用,与糖原合成有关。糖原为密集堆积的小颗粒,可经一种溶酶体酶(酸性麦芽糖酶)水解为葡萄糖。
通过细胞器和其所含的各种酶,肝细胞能在同一时间内进行及完成许多重要生化反应,如合成、结合、水解、贮存、分泌、排泄和吸收等。
肝脏检查特点 正常新生儿及初生4个月内,肝下界于右锁骨中线肋缘下2cm扪及,5岁以下可于肋缘下1cm扪及。叩诊时,肝脏浊音上界于右锁骨中线第5或第6肋处,右腋中线在第7肋间,腋后线于第9肋处。正常小儿肝脏边缘柔软,稍锐但无压痛,表面光滑。小儿胆囊被肝叶遮盖,较少可被扪及。
- 鲁石公是什么意思
- 鲁砚是什么意思
- 鲁礼祫禘义是什么意思
- 鲁礼禘祫疏证是什么意思
- 鲁礼禘袷志是什么意思
- 鲁礼褅祫志是什么意思
- 鲁祖轸是什么意思
- 鲁禽是什么意思
- 鲁禽情是什么意思
- 鲁秀珍是什么意思
- 鲁秋洁妇是什么意思
- 鲁秋胡妻是什么意思
- 鲁穆公是什么意思
- 鲁穆庭是什么意思
- 鲁穴是什么意思
- 鲁章是什么意思
- 鲁端王墓是什么意思
- 鲁笔是什么意思
- 鲁笨是什么意思
- 鲁米利亚是什么意思
- 鲁米那是什么意思
- 鲁素艳是什么意思
- 鲁索袭击是什么意思
- 鲁紫铭碑林是什么意思
- 鲁絜非是什么意思
- 鲁纪华是什么意思
- 鲁纯仁是什么意思
- 鲁纯生是什么意思
- 鲁经是什么意思
- 鲁绣是什么意思
- 鲁绣芙蓉双鸭图轴是什么意思
- 鲁绣荷花鸳鸯图轴是什么意思
- 鲁继曾是什么意思
- 鲁绸是什么意思
- 鲁缅采夫是什么意思
- 鲁缅采夫,阿列克谢·马特维耶维奇是什么意思
- 鲁编修、鲁小姐是什么意思
- 鲁缟是什么意思
- 鲁缟如白烟,五缣不成束。是什么意思
- 鲁缟齐纨是什么意思
- 鲁美尼亚是什么意思
- 鲁翁是什么意思
- 鲁联禄是什么意思
- 鲁肃是什么意思
- 鲁肃上了孔明的船——稀里糊涂是什么意思
- 鲁肃上了孔明的船——错了是什么意思
- 鲁肃与刘备是什么意思
- 鲁肃与孙权是什么意思
- 鲁肃传是什么意思
- 鲁肃墓是什么意思
- 鲁肃服孔明——五体投地是什么意思
- 鲁肃治洪是什么意思
- 鲁肃的人物故事|评价|小传,鲁肃的事迹|史鉴是什么意思
- 鲁肃讨荆州是什么意思
- 鲁肃:教你怎样和上司说话是什么意思
- 鲁肇忠是什么意思
- 鲁胜是什么意思
- 鲁胤昌是什么意思
- 鲁腾堡是什么意思
- 鲁至道是什么意思