化学平衡常数的计算
化学平衡常数的计算huaxue pingheng changshu dejisuan
在一定条件下处于平衡状态的可逆反应,mA+nBpC+qD,生成物浓度乘积与反应物浓度乘积之比为一常数,即:
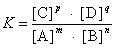
❶各物质的浓度必须用平衡浓度,浓度的指数是化学方程式中该物质分子式前的系数。
❷在气体参加的反应中,有固体及纯液体时,不考虑其浓度。
有关平衡常数的计算关系如下。

例1 已知某温度下合成氨反应
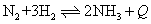
达平衡时,[N2]=3mol·L-1,[H2]=8mol·L-1,[NH3]=4mol·L-1。试求: 此温度下的化学平衡常数;用下列方程式表示上述反应时平衡常数的值应为多少?

同一化学反应可用不同形式的热化学方程式表示。化学方程式的形式和系数不同,常数值也就不同。
例2 某温度下,氢气和碘蒸气化合生成碘化氢的平衡常数是50,已知碘蒸气起始浓度为1mol·L-1,达平衡时有0.9mol·L-1碘化氢生成,求氢气的起始浓度和平衡浓度。

答 氢气起始浓度为0.48mol·L-1,平衡浓度为0.03mol·L-1。
对于一定条件下可逆反应的某种状态,如果生成物与反应物的浓度积之比(即将各物质的浓度数值代入平衡常数表达式)等于平衡常数K,这种状态在该条件下即为平衡状态。如果不等于平衡常数,即为不平衡状态。
❶若小于K,平衡向正反应方向移动;
❷ 若大于K,平衡向逆反应方向移动。利用这种关系,通过计算,可以判断平衡能否发生移动以及移动的方向。
例3 已知二氧化硫与氧气反应,在某温度下达平衡,此时各物质的浓度是 〔SO2〕=0.1mol·L-1,[O2]=0.05mol·L-1,[SO3]=0.9mol·L-1。如果平衡混合物温度不变,缩小体积,使混合物压力增大一倍。试通过计算说明平衡移动的方向。

答 该反应在温度不变时,缩小体积,平衡向正反应方向移动。
☚ 化学反应速率的计算 转化率的计算 ☛
- T000117 系统可靠性工程基础是什么意思
- T000118 实用工程传质学是什么意思
- T000119 自动控制中的基础数学是什么意思
- T000120 应用动态规划是什么意思
- T000121 简明工程力学是什么意思
- T000122 现代控制理论基础是什么意思
- T000123 可靠性管理技术是什么意思
- T000124 塑性分析在结构设计中的应用是什么意思
- T000125 工程力学是什么意思
- T000126 工程优化的算法与分析是什么意思
- T000128 离散论方法学是什么意思
- T000129 大型工程决策是什么意思
- T000130 管理工效学是什么意思
- T000131 振动与冲击手册是什么意思
- T000132 可靠性维修性总论是什么意思
- T000133 弹性动力学是什么意思
- T000134 实用工程数学是什么意思
- T000135 工程光学基础是什么意思
- T000136 工程流体力学是什么意思
- T000137 实用概率统计学是什么意思
- T000138 工程光学是什么意思
- T000139 模糊数学与工程科学是什么意思
- T000140 工程力学手册是什么意思
- T000141 《可靠性工程与管理》电视讲座教材是什么意思
- T000142 计算方法是什么意思
- T000143 工程振动学是什么意思
- T000144 地下工程平面问题弹性有限元图谱是什么意思
- T000145 工程力学是什么意思
- T000147 振动力学是什么意思
- T000148 优化计算方法是什么意思
- T000150 工程结构抗爆动力学是什么意思
- T000151 边界元方法及其在工程中的应用是什么意思
- T000152 工程实用边界单元法是什么意思
- T000153 机电产品的可靠性是什么意思
- T000154 可靠性工程——设计、试验、分析、管理是什么意思
- T000155 工程数学是什么意思
- T000156 工程力学是什么意思
- T000157 塑性力学有限元——理论与应用是什么意思
- T000158 应用最优控制是什么意思
- T000159 工程运筹学是什么意思
- T000160 工程断裂力学是什么意思
- T000161 自适应控制系统理论、设计与应用是什么意思
- T000162 可靠性评定是什么意思
- T000163 工程气固多相流动的理论及计算是什么意思
- T000164 实用工程数学是什么意思
- T000165 工程控制理论是什么意思
- T000166 振动模态分析与参数辨识是什么意思
- T000167 键合图在工程建模中的应用是什么意思
- T000168 工程优化原理及应用是什么意思
- T000171 板壳力学是什么意思
- T000172 工业产品的标准化与质量是什么意思
- T000174 工程控制理论是什么意思
- T000175 工程控制论是什么意思
- T000176 可靠性基础入门是什么意思
- T000177 工程分离流动力学是什么意思
- T000178 时间序列分析的工程应用是什么意思
- T000179 质量工程学是什么意思
- T000180 管道水击分析与控制是什么意思
- T000181 弹塑性断裂力学工程应用指南是什么意思
- T000182 控制工程基础是什么意思