分光光度法
光学仪器分析法的一种。根据物质对不同波长的单色光的吸收程度不同而对物质进行定性和定量分析的方法。光源发生的复合光经单色器单色化后,分别通过盛样品溶液及参比溶液的吸收池,再投射到接受器。测定出溶液对各种光的吸光度(或透光率),由吸光度(或透光率)与波长绘制的吸收曲线可对该物质进行定性分析。由一定波长得到的吸光度与物质浓度画出的工作曲线可进行定量分析。该方法的测量范围除可见光区域外,已扩展到紫外和红外光区域。其优点是灵敏度和准确度高,可同时测定溶液中两种或两种以上的组分。
分光光度法spectrophotometry
是以单色光通过样品后测量物质对单色光的吸收程度,从而确定物质的组成及其含量的一种吸收光谱法。测量物质对不同波长单色光的吸光度不同,以波长对吸光度作图,可绘出一条吸收光谱曲线。根据吸收光谱曲线的形状和峰值,可研究物质的分子结构和作定性分析。
分光光度法
分光光度法是根据溶液对一定波长的光的吸收度,利用分光光度计来确定溶液浓度的一种仪器分析方法。
根据溶液对光具有选择性吸收的特征,选用容易被检测成分析吸收的光通过溶液,根据透射光强度的减弱程度,便可测定被测成分的含量,这是分光光度法的基本原理。此法不仅能测定可见光区有吸收成分的含量,也可测定其它光区有吸收成分的含量,不仅能测定样品中单一成分的含量,也可利用溶液中各种成分对光的选择吸收不同而分别测定多种成分的含量。分光光度法还可利用物质的吸收光谱和吸光系数特征鉴别物质的存在,作定性分析,因而是一种应用较广的分析方法。
可见-紫外分光光度法,与吸光分析法中光电比色原理相同,所不同的是在分光光度法中所用的入射光单色纯度较高。分光光度计中具有精微的单色光器,使产生的单色光接近于理想单色光,其它部件的精密度都较比色计高,其精密度可达0.5%,若仪器经校正可提高到0.2%,因而此法比光电比色法更为方便、、准确、灵敏。
分光光度法在分析化学领域中占有重要位置,也是医药卫生研究中最常用的测定物质含量的分析方法之一。由于其灵敏度高,一般可测到每毫升10-7g(0.00001%)以下样品。作为一种仪器分析,具有设备简单、分析快速、结果准确的优点,故可被广泛采用。
原理
辐射能与分子的相互作用 溶液对光具有选择性吸收的特征,这是设计分光光度法的基本出发点。
物理学的实验表明: 光具有波粒二象性。从波动的观点出发,光是一种按横波形式传播的电磁波,具有波长(λ)、速度(c)及频率 (v),且它们之间具有c=vλ (1)的关系。光的波动理论解释了反射、折射、衍射等光学现象。从微粒观点出发,则认为光束是带能量的微粒组成,一定频率 (或波长) 的光是由一定能量的光子组成的。光子的能量与其光的频率及波长有关。其关系可用下式表示:
式中: E: 光子能量,单位是电子伏特(eV)1eV=1.602×10-19J
h:普朗克常数,其值为6.63×10-34J/s
v: 光的频率,单位: Hz(赫兹),或周/秒或次/秒
λ: 波长,单位: cm、m、μm、nm等
c: 光速,单位: cm/s,真空中c=3×1010cm/s
从(2)式可知,电磁波的波长越长,频率就愈低,光子能量就越小; 反之,电磁波波长愈短,频率就越高,光子的能量就越高,因而不同波长频率的电磁波,它们所具有的能量是不同的。
可见光是指人眼能感觉到的光,波长约在400nm~760nm。紫外光波长在400nm以下,红外光波长在760nm以上,它们所具有的光子能量也是不同的。
分子所具有的内能由三部分组成:
❶分子可绕不同的轴旋转具有一定量的转动能;
❷分子内部的原子或原子团在它们的平衡位置上相互作用作周期性运动,使分子具有振动能;
❸分布在原子核周围的电子相联系的位能。
E内能=E电子能+E振动能+E转动能
量子论的基本概念指示: 分子不可能具有任何任意量的内能,仅可在一定“允许的”能级状态下存在。若原子或分子中的各个电子都在“基态”轨道中运动,体系的能量最低,并维持不变。若原子或分子处于电磁辐射的作用下,就可能选择吸收了其中某些电磁波,使电子从“基态”轨道跃迁到“激发态”轨道中去。体系能量的升高值是由电子跃迁所引起的,应以ΔE电子表示,而此能量的获得是由它所选择吸收的电磁波所供给的,也即: 可见,如果某种波长的光所具有的能量与某种物质的电子跃迁所需的能量相符合时,则被该物质最大吸收。
可见,如果某种波长的光所具有的能量与某种物质的电子跃迁所需的能量相符合时,则被该物质最大吸收。分子能量的量子化结合光子具有一定能量的概念,确定了分子在吸收辐射能时的选择程度,如用不同波长的光照射分子时,分子将从入射光中吸收适合于分子能量跃迁的相应波长光子的能量,而其它波长的光线将被简单透过。
必须指出的是,可见到紫外光的吸收增加了分子的电子能,但分子在电子跃迁的同时必然也存在分子的振动与转动。这样,分子的电子跃迁并不如自由电子的电子跃迁时只吸收单线辐射的能量ΔE电子。而是吸收一个波段辐射的能量ΔE,从而使连续光谱中出现黑带,使吸收光谱成了带状光谱。
吸收定律
由上可知,某种物质的分子结构,决定它只能吸收一定波长的光。当用这种波长的光透过该物质的溶液时,所发生的变化,可用下述定律说明:
(1) 朗伯定律: 1760年,朗伯(Lambert)研究了溶液的液层厚度与其吸光度的关系。如右图。当一束强度为I0的单色光通过溶液后,其中一部分光线被吸收,透射光It的强度比I0弱。溶液浓度不变时,若液层厚度越大,透射光强度的减弱越显著。且有如下关系:It=I0K1-b (1)
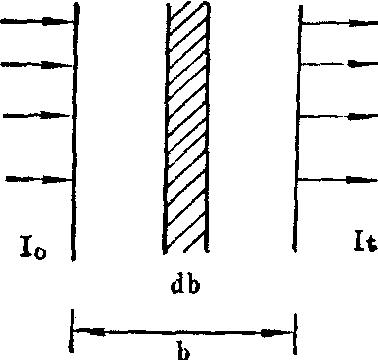
光吸收示意图
式中K1是常数,决定于入射光波长,溶液的性质和温度等。b是液层厚度。
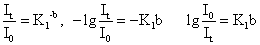
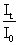 称为透光度,用T表示,是小于1的数值,为了使用上的方便,常把T乘以100,称为百分透光度(或称透光率)用%表示。
称为透光度,用T表示,是小于1的数值,为了使用上的方便,常把T乘以100,称为百分透光度(或称透光率)用%表示。
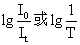 称为吸光度(A),又称消光度 (E)或光密度(D)
称为吸光度(A),又称消光度 (E)或光密度(D)A(E或D)=k1b(2)
上式说明,当入射光波长、溶液浓度和温度一定时,溶液的吸光度与溶液液层厚度成正比。此即朗伯定律。
(2) 比耳定律: 1852年,比耳(Beer)研究了溶液浓度与其吸光度的定量关系,当一束强度为I0的单色光通过溶液后,其中一部分光线被吸收,因此透射光It比I0弱。液层厚度不变时,若溶液浓度愈大,透射光It的强度的减弱就愈显著,并有如下关系:
It=I0K2-c (3)
式中K2是常数,决定于入射光波长,溶液的性质和温度等。c是溶液的浓度。
A=K2c (4)
上式说明当入射光波长,溶液液层厚度和温度一定时,溶液的吸光度与溶液的浓度成正比,这就是比耳定律。
(3) 朗伯-比耳定律: 将(2)式与(4)式合并,并令k1k2=a则可得到下列关系:
A=a·b·c (5)
式中a是比例系数,称吸光系数,也可称消光系数。a 值的大小,决定于入射光波长、溶液的性质和温度等。
c是溶液的浓度,单位: mol/L,g/L或g/dl
b是液层的厚度,单位: cm
这就是朗伯-比耳定律。它说明了溶液的吸光度与溶液的浓度和液层的厚度乘积成正比。朗伯-比尔定律又称吸收定律,是分光光度法定量分析的基本依据,不仅对溶液适用,而且对气体、固体也适用,除了适用于紫外可见光外,也适用于其它区域的电磁波的吸收。
(4) 摩尔吸光系数: 当溶液的浓度c用摩尔/升 (mol/L)、液层厚度用厘米为单位时,式 (5)中的a应使用ε作符号,ε称为摩尔吸光系数,(或称摩尔消光系数)。表示在一定温度下,溶液浓度为1mol/L,液层厚度为1cm时溶液的吸光度。单位为升/摩尔 ·厘米 (L/mol·cm)。某一物质的溶液在最大吸收波长处所测得的摩尔吸光系数用ελmax表示。
摩尔吸光系数是一个特征系数,不同的物质可能有相同的最大吸收波长λmax,但它们的ελmax不一定相等。因此,εmax或λmax相当于物质的熔点和沸点的常数。可作物质定性的依据。
摩尔吸光系数值的大小还可以反映吸光分析方法的灵敏度。ελmax愈大,则灵敏度愈高。通常的ελmax在10~105之间,若ελmax>104是为强吸收,灵敏度高,在103~104之间为中吸收,在103以下灵敏度就差了。
方法 紫外及可见分光光度测定通常是在溶液中进行。故操作时首先需选用合适的溶剂将各种试样转变成溶液。
若要用分光光度法测定某一物质的吸收光谱。则用可见光或紫外光的一系列波长的单色光,按波长由长到短的顺序逐一地先通过空白溶液然后再通过测定溶液。可分别测得该溶液的一系列不同波长的吸光度。以吸光度为纵坐标,各单色光波长为横坐标作图,就可以得到某溶液的吸收光谱图。由此又得λmax。用分光光度法作定量测定时,有以下几种方法:
标准曲线测定法 首先配制一系列(5~10个) 浓度为梯度的标准溶液。以纯溶剂或空白溶液作参比。首先用参比溶液在λmax处调节其百分透光度为100(A=0)。然后再测定每一个标准溶液的吸光度。用方格坐标纸以溶液浓度为横坐标,以吸光度为纵坐标作图。若被测溶液的浓度对光的吸收符合朗伯-比耳定律,则得到一条经原点的直线,称为标准曲线。按同样的方法配制样品溶液并测定其吸光度,就可在工作曲线上查出对应的浓度。如果显色反应的产物它的浓度与吸光度不完全符合朗伯-比耳定律时,只要工作曲线重演性好,亦可作一般测定之用。
直接比较测定法 凡被测溶液符合吸光定律都可应用。先配制一个浓度接近于被测溶液浓度的标准溶液如浓度为C标准,它的吸光度为A标准。然后再测定被测溶液的吸光度A样品。根据吸光定律便可算出被测溶液浓度。
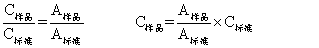
相对吸光光度法 又称差示分光光度法。当试样溶液浓度过高时,若仍以空白溶液作参比,误差会很大。若以一定浓度的标准溶液作参比,就可能减小由于溶液太浓引起的误差。这种测量方法称为“差示法”。差示法能提高准确度的原理如下:
设试样溶液浓度为Cx、参比溶液浓度为C,,而C
Ex=KCxL;E=KCL
两式相减得: Ex-E=KL(Cx-C)
当L一定时: △E=K△C
上式说明,试样溶液与参比溶液的消光度之差,与两溶液的浓度之差成正比。由于Cx比Cx-C (即△C)大得多,故测得的Cx的误差就比△C的误差小得多。若Cx比△C大10倍,而测定△C的相对误差是±3%时,对Cx来说,相对误差只有±0.3%。
分光光度计 分光光度法使用的仪器为分光光度计。目前在我国的医药卫生实践工作中,一般多用国产的721(360~800nm)一型可见分光光度计、751(200~1000nm)一型可见一紫外分光光度计和710(187~2500nm)一型可见紫外分光光度计,双光束分光光度计、752一型分光光度计等等。
应用
定性分析 用紫外光谱鉴定一个化合物,就是把该化合物的光谱特征如吸收峰的数目、位置、强度 (摩尔吸光系数)以及吸收峰的形状 (极大、极小和特点),与纯化合物的标准紫外光谱图作比较,如果两者非常一致,尤其是当未知化合物的光谱含有许多锐利而且很有特征性的吸收峰时,可以认为这两个化合物具有相同的生色基,以此推定未知物的骨架,或认为就是同一化合物。但因溶液中测定的大多数有机物的紫外光谱,其谱带数不多,且谱带宽而缺少精细结构,特征性不明显。故紫外光谱常配合红外光谱、质谱和核磁共振波谱进行有机物结构研究。
定量测定 (1) 单一成分含量的测定: 方法如上述。
(2) 多组分混合物的同时测定:
对于一个含有多种吸光组分的溶液,在某一测定波长下,其总吸光度应为各个组分的吸光度之和。即: A总 =∑A1=L∑ε1Ci,这样,即使各个组分的吸收光谱互相重叠,只要服从比耳定律,就可根据此式测定混合物组分中各组分的浓度。最简单的是二组分混合物分析。
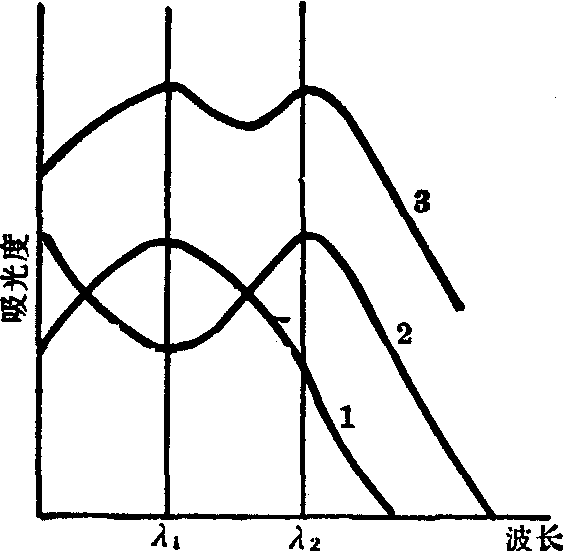
二组分混合物吸收曲线
如某一试液中,含有浓度分别为C1和C2的两个组分,它们的吸收曲线如上图。设A1和A2分别为在λ1和λ2波长下所测得的试液的总吸光度。ε′λ1和ε′λ2为第一个组分的摩尔吸收系数,ε″λ1和ε″λ2为第二个组分的摩尔吸收系数。吸收池厚度为1cm。根据比耳定律和吸光度的加和性,可得如下两式:
Aλ1=ε′λ1C1+ε″λ1C2
Aλ2=ε′λ2C1+ε″λ2C2
(3) 催化分光光度法: 是一种测定催化反应速度为基础的定量分析方法。如催化剂反应是一个显色或退色反应,就可用分光光度法测定催化反应的反应物或生成物之一的浓度变化,这就是催化分光光度法。被测组分是催化剂。
(4) 分光光度滴定: 在定量滴定分析时,若被测组分、滴定剂或反应产物在紫外区或可见光区有特征性吸收,就可通过测定滴定体系的吸光度变化来指示滴定过程的滴定终点,这就是分光光度滴定。
此外,分光光度法还可用作研究溶液中络合物的形成。在生物化学实验中,常用此法定量测定蛋白质、核酸等生物大分子。
分光光度法
分光光度法是基于物质对光的选择性吸收的分析方法。当一定波长的光照射到物质的溶液,由于该物质对光的吸收,光透过溶液后,光强度发生变化,根据波长与该波长处光强度变化的大小而对物质进行定性和定量。
物质对不同波长光的吸收有所不同,表示物质在不同波长的光吸收强度变化的曲线称吸收光谱,吸收光谱是物质特性,可用于定性鉴别。(见“紫外吸收光谱”与“红外吸收光谱”条)
当一定波长,强度为I0的入射光,照射到含一定量物质的溶液,一部分光被吸收,透射光的强度下降为I,I和I0与所测物质浓度有下述关系:
A=log(I /I)=ε·c·l
/I)=ε·c·l
称为比耳定律。ε为该物质的吸光系数,c为浓度,l为液层厚度,A为吸光度。若l不变,对特定物质A∝c,故测定吸光度,即能决定溶液中物质浓度。测定时,先用已知浓度标准品测出吸光系数或绘制标准曲线,再将测定样品的吸光度与之比较而求得含量。
药典中吸光系数常用E1cm 1%表示,即溶液浓度为1%(g/ml),液层厚度为1cm时的吸光度。
测量时需使用单色光,用棱镜或光栅进行分光后获得,根据单色光波长的不同,可以分为紫外光度法 (波长200~400nm)、可见光度法(波长400~800nm) 及红外光度法 (波长2~15μm);所使用的仪器相应地称为紫外、可见与红外分光光度计。如不用棱镜或光栅而用滤光片产生单色可见光,则称为比色法,仪器称为比色计。
紫外分光光度法主要用于含不饱和键的化合物,尤其是芳香化合物,可见分光光度法及比色法用于有色物质,红外分光光度法一般误差较大,在定量中用得较少,多用于定性鉴别。
分光光度法
spectrophotometry
- 蛇黄是什么意思
- 蛇黄丸是什么意思
- 蛇黄丸是什么意思
- 蛇黄丸是什么意思
- 蛇黄丸是什么意思
- 蛇黄丸是什么意思
- 蛇黄丸是什么意思
- 蛇黄丹是什么意思
- 蛇黄散是什么意思
- 蛇黄散是什么意思
- 蛇黄散是什么意思
- 蛇黄散是什么意思
- 蛇黄紫金丹是什么意思
- 蛇黄饼子是什么意思
- 蛈蝪是什么意思
- 蛉是什么意思
- 蛉嫂探亲是什么意思
- 蛉穷是什么意思
- 蛊是什么意思
- 蛊是什么意思
- 蛊gǔ是什么意思
- 蛊惑人心是什么意思
- 蛊惑人心是什么意思
- 蛊惑人心是什么意思
- 蛊惑人心是什么意思
- 蛊惑(鼓惑) 迷惑是什么意思
- 蛊毒是什么意思
- 蛊毒候导引法是什么意思
- 蛊毒利是什么意思
- 蛊毒病是什么意思
- 蛊毒病是什么意思
- 蛊注是什么意思
- 蛊注是什么意思
- 蛊注是什么意思
- 蛊注痢是什么意思
- 蛊注痢是什么意思
- 蛊疝是什么意思
- 蛊症散是什么意思
- 蛊胀是什么意思
- 蛊胀是什么意思
- 蛊胀奇方是什么意思
- 蛋是什么意思
- 蛋是什么意思
- 蛋不老是什么意思
- 蛋不老是什么意思
- 蛋不老是什么意思
- 蛋制品是什么意思
- 蛋制品加工是什么意思
- 蛋卜是什么意思
- 蛋卜是什么意思
- 蛋卜择墓是什么意思
- 蛋品消毒是什么意思
- 蛋品脱糖是什么意思
- 蛋壳厚度是什么意思
- 蛋婚是什么意思
- 蛋婚是什么意思
- 蛋子和尚三盗袁公法是什么意思
- 蛋崇拜是什么意思
- 蛋彩画是什么意思
- 蛋氨酸是什么意思