凝固点降低
凝固点降低ninggudian jiangdi
纯溶剂的凝固点是在一定外压下 (一般是常压),其液相和固相达到相对平衡时的温度。若在溶剂中加入一些溶质形成稀溶液,当降低温度时,先凝固出固态纯溶剂,此时固态纯溶剂与溶液呈两相平衡,其平衡温度称为溶液的凝固点。由于溶液蒸气压降低,此时冰的蒸气压高于溶液的蒸气压,故纯溶剂不能凝固出,只有温度降低到使冰的蒸气压与溶液蒸气压相等时,才能使固态纯溶剂与溶液达到平衡,故溶液的冰点要低于纯溶剂的冰点。实验证明,稀溶液的凝固点降低值与溶液的质量摩尔浓度(mB)成正比,即
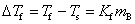
式中Ts——溶液凝固点
Tf——纯溶剂凝固点△f-——凝固点降低值
Kf——凝固点下降常数,水的凝固点即为冰点,其Kf为1.86
☚ 沸点上升 渗透压 ☛
- 马恶性贫血是什么意思
- 马悟真是什么意思
- 马患诸病方是什么意思
- 马悦卿是什么意思
- 马惇靖是什么意思
- 马惜障泥是什么意思
- 马惟厚是什么意思
- 马惠是什么意思
- 马惠明是什么意思
- 马惠迪是什么意思
- 马愈行书暑气帖是什么意思
- 马愉是什么意思
- 马愿如羊是什么意思
- 马慈国是什么意思
- 马慈甫是什么意思
- 马慎之是什么意思
- 马慎贤是什么意思
- 马慵立仗是什么意思
- 马懋功是什么意思
- 马戈格是什么意思
- 马戎是什么意思
- 马戎第是什么意思
- 马戏是什么意思
- 马戏之乡是什么意思
- 马戏团是什么意思
- 马戏团主持人是什么意思
- 马戏团乐队是什么意思
- 马戏团全体人员是什么意思
- 马戏团员是什么意思
- 马戏团大篷车是什么意思
- 马戏团女演员是什么意思
- 马戏团宣传员是什么意思
- 马戏团导演是什么意思
- 马戏团射手是什么意思
- 马戏团小丑是什么意思
- 马戏团指导是什么意思
- 马戏团用具是什么意思
- 马戏团经理是什么意思
- 马戏团经营术是什么意思
- 马戏团舞蹈演员是什么意思
- 马戏团领班是什么意思
- 马戏团马术演员是什么意思
- 马戏图是什么意思
- 马戏场是什么意思
- 马戏场乐台是什么意思
- 马戏场包厢是什么意思
- 马戏场后台是什么意思
- 马戏场围场是什么意思
- 马戏场大帐篷是什么意思
- 马戏班是什么意思
- 马戏节目是什么意思
- 马戏表演是什么意思
- 马戏观众是什么意思
- 马戏迷是什么意思
- 马成是什么意思
- 马成奸盗案是什么意思
- 马成寺村是什么意思
- 马成破李宪之战是什么意思
- 马或奔踶而致千里,士或有负俗之累而立功名是什么意思
- 马或奔踶而致千里,士或有负俗之累而立功名。是什么意思