免疫球蛋白
不同年龄的人,免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、免疫球蛋白A(IgA)的含量参考值分别为(单位):脐血6.5~16.0,<0.25,0.01~0.04;1个月2.5~9.0,0.20~0.80,0.02~0.5;2~12个月2.0~10.7,0.25~1.5,0.04~0.9;1~5岁3.4~12.4,0.45~2.0,0.15~1.6;6~12岁6.5~16.0,0.50~2.5,0.35~2.5;成人6.5~16.0,0.50~3.0,0.40~3.5。
免疫球蛋白immunoglobulin,Ig
简称Ig,系一种具有抗体活性的球蛋白。是机体受到病原微生物侵袭或抗原刺激后由浆细胞而产生的特异性抗体,存在于血浆及淋巴液等体液中,能和同一抗原发生特异性免疫反应。免疫球蛋白分为5种,即IgG、IgA、IgM、IgD、IgE等。它们有共同的基本结构,即由2条相同的重肽链和2条相同的轻肽链结合而成;并都有抗体的活性,即作用于抗原,激活补体系统,破坏带抗原的靶细胞。医药卫生应用的免疫球蛋白主要是由胎盘、脐带血液和健康血液制成,用于医疗的有抗狂犬病免疫球蛋白、抗百日咳免疫球蛋白、乙型肝炎免疫球蛋白、抗绿脓杆菌免疫球蛋白等。各种免疫球蛋白功能不尽相同,详见各词条。
免疫球蛋白
见“医药卫生”中的“免疫球蛋白”。
免疫球蛋白
见“医药卫生”中的“免疫球蛋白”。
免疫球蛋白
即“抗体”。
免疫球蛋白
是血浆内具有免疫活性、起防御作用的球蛋白。体内形成免疫球蛋白的器官是脾和淋巴结,由成熟的浆细胞分泌。它可分为5类,即IgG、IgA、IgM、IgD和IgE。
❶IgG:分布于体液中(血清中含量最多),主要由脾脏和淋巴结中的浆细胞合成。它是临床使用的丙种球蛋白、抗菌抗体、抗毒素、抗病毒血清及免疫血清的主要成分。
❷IgM:在种系进化,个体发育及抗体应答中均为最先出现的免疫球蛋白,即起着先锋免疫作用。临床证明,检查IgM有助于传染病的早期诊断。IgM能结合补体、溶菌、溶细胞和中合病毒作用,尤其是对革兰氏阴性菌有很强的杀伤作用。
❸IgA:分为血清型和分泌型。血清型存在于血清中,其作用尚不清楚。分泌型存在于泪液、唾液、鼻腔液及胃肠、气管、生殖、泌尿道的分泌液中,具有抗粘膜感染作用。
❹IgD:正常人血清中含量很少,免疫学功能尚不清楚。其合成受浆细胞数量限制,慢性感染时血清中IgD浓度增高。
❺IgE又称反应素,由肠道与呼吸道淋巴结的浆细胞合成,然后进入血液及外分泌液。它容易与同种或相近种属组织的肥大细胞及血液中的嗜碱性粒细胞相结合,即所谓亲同种细胞抗体。当抗原与IgE结合时,则促使肥大细胞、嗜碱性粒细胞释放各种活性物质,如组织胺等。
免疫球蛋白immunoglobulin,Ig
目前已发现有五种,即IgM、IgG、IgA、IgE及IgD,存在于血清、体液及外分泌液中。每一个抗体球蛋白分子均由两条相同的轻链及两条相同的重链组成,链与链间通过二硫键及非共价键相连接,同一链上也有二硫键相连。
免疫球蛋白
免疫球蛋白是一类主要存在于血浆中具有抗体活性的糖蛋白。对血清进行电泳后发现,抗体成分存在于β和γ球蛋白部分,故通称为免疫球蛋白(Ig)。免疫球蛋白约占血浆蛋白总量的20%。免疫球蛋白除存在于血浆中外,也少量地存在于其它组织液、外分泌液和淋巴细胞的表面。
免疫球蛋白的化学结构 在人类根据一些理化性质的区别,可将Ig分成五类,即IgG、IgA、IgM、IgD和IgE。这五类Ig的主要理化特征见表1。
虽然Ig的成分很复杂,但各种类型的Ig分子的基本结构(或称单体Ig)是相似的。Ig分子的基本结构见图1。单体Ig由四条多肽链组成,两条较长的称为重链(H链),两条较短的称为轻链(L链)。两条相同的重链通过链间二硫键连接,两条相同的轻链也由链间二硫键连接在两条重链的两侧。
表1 人类免疫球蛋白的理化性质
| IgG | IgA | IgM | IgD | IgE | |
| 沉降系数 | 6~7s | 7s | 19 s | 7~8s | 8s |
| 分子量 | 150 000 | 160 000* 400 000s | 900 000 | 180 000 | 190 000 |
| 电泳率 重链 | γ γ | 快γ到β α | 快γ到β μ | 快γ σ | 快γ ε |
| 轻链 | κ和λ | κ和λ α2L2*或 | κ和λ | κ和λ | κ和λ |
| 分子式 | γ2L2 | (α2L2)2S+J? | (μ2L2)5J? | δ2L2 | ε2L2 |
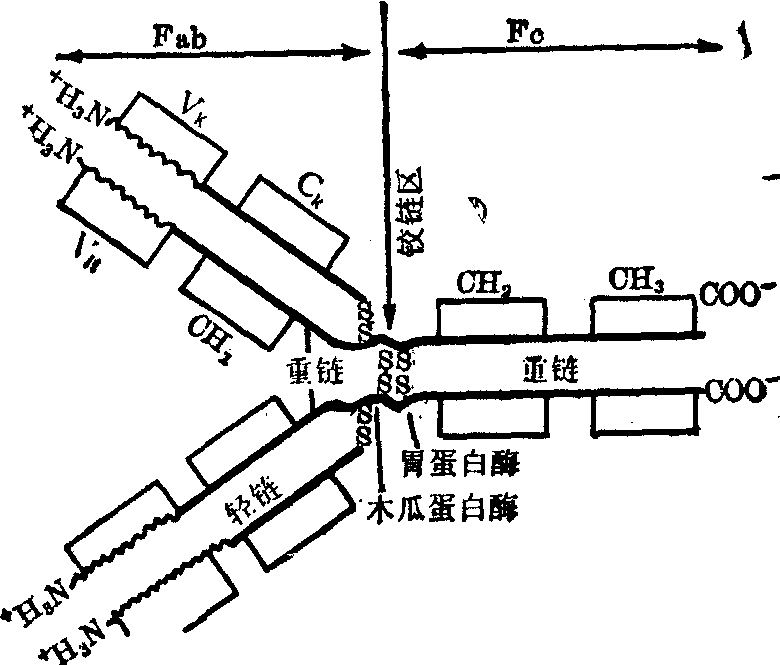
图1 Ig分子基本结构示意图
重链和轻链的羧基端一侧的氨基酸排列比较恒定,称为恒定区,分别为CH和CL;重链和轻链在恒定区之外的氨基酸排列顺序变化较大,这一段是可变区,分别称为VH和VL。
重链的中间部分肽段脯氨酸残基相对较多,不能形成螺旋结构,因此这区域的伸展性比较大,易于暴露在分子的表面而受到酶或其它化学试剂的作用,称为铰链区。由于铰链区的存在,Ig分子的形状可在“Y”型和“T”型之间互变。不结合抗原时,Ig分子呈“T”型;结合抗原后,则成为“Y”型。
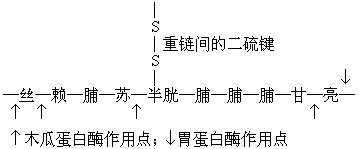
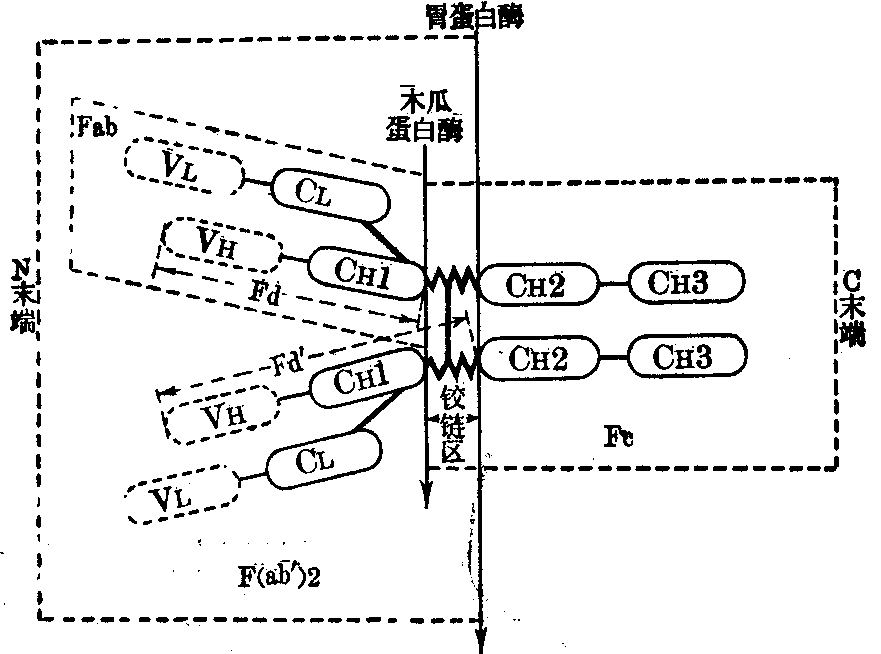
木瓜蛋白酶可将Ig分子水解成两个Fab片和一个Fc片。胃蛋白酶水解Ig分子,可得一个F(ab′)2片和不完整的Fc片。木瓜蛋白酶和胃蛋白酶对Ig的作用点见图2。Fab具有一个抗原结合点,F(ab′)2具有两个抗原结合点。完整的Fc也保留了原有的生物活性。
骨髓瘤蛋白是由骨髓瘤浆细胞产生的与Ig结构相同的蛋白质,Bence-Jones蛋白是骨髓瘤蛋白的两条轻链。由于它们结构上的均一性,因此被用来研究Ig分子的一级结构和高级结构。多种骨髓瘤蛋白和Bence-Jones蛋白的氨基酸顺序分析结果说明,在VH和VL中某些位置的氨基酸排列是比较恒定的,如轻链的第99~102位氨基酸为-苯丙-甘-甘-甘-,VH的相对位置上出现-酪-甘-甘-甘-的恒定排列。这些位置上的氨基酸的恒定或半恒定的排列在维持Ig分子的高级结构中起作用。
VH和VL中有一些部分的氨基酸排列的变化程度很大,称为高变区。VH有四个高变区,属于高变区的氨基酸有30个; VL有三个高变区, 属于高变区的氨基酸有25个。Ig分子中的高变区构成与抗原的结合部位。
重链和轻链分别有链内二硫键维系构成几个三维结构紧密的呈球形的区域,又称功能区。重链一般有四个功能区(IgM的重链有五个功能区),分别称为VH,CH1,CH2,CH3(或CH4); 轻链有两个功能区,VL和CL。氨基酸顺序分析和x衍射的结果都说明,这些功能区的一级结构和空间结构都十分相似,因此,就基因来源来讲是同源区。这些区域的二级结构是以β-折叠为主,很少存在或不存在螺旋结构(图2) 见图,每个功能区都有两个β折叠片,一个折叠片由四股逆平行的肽链组成,另一个折叠片由三股逆平行的肽链组成。两个折叠片之间主要是一些非极性和疏水氨基酸残基的侧链存在,形成一个疏水空间。
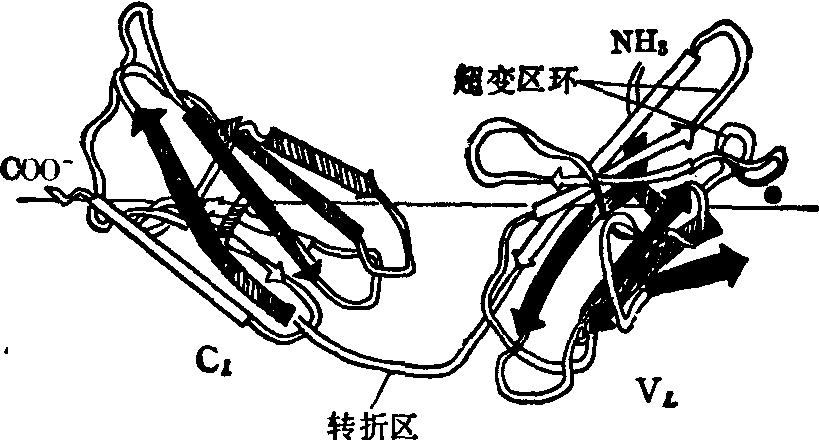
图2 Bence-Jones蛋白的三维结构
免疫球蛋白的不均一性 Ig不是均一的蛋白质,按照Ig分子的化学结构和免疫特异性的不同可分为如下类、型、群:
(1) 类: 由于重链恒定区的抗原性不同,重链可分为γ、α、μ、δ和ε,这五类重链组成的Ig分别是IgG、IgA、IgM、IgD和IgE。
(2) 亚类: 每类Ig重链恒定区上的免疫化学性质也有差异,因此将某些类的Ig分成亚类,如人类IgG有IgG1~IgG4四个亚类,IgA有IgA1和IgA2两个亚类,IgM也有IgM1和IgM2两个亚类。
(3) 型: 根据轻链恒定区的化学结构的差别,可将轻链分为к和λ两型。同一Ig分子上的两条轻链总是同型的。
(4) 亚型: 由于λ轻链的恒定区的化学结构上的微小差异,可将λ轻链分成若干亚型,如λ轻链上的190位是亮氨酸时称为Oz(+)亚型,为精氨酸时称为Oz(-) 亚型。
(5) 亚群: 根据Ig分子重链和轻链可变区一级结构的差别可分为各种亚群,如重链可变区有VHI~VHIV四个亚群:λ轻链的可变区有Vλ I~Vλ VI六个亚群; K轻链的可变区可分为VKI~VRIV四个亚群。
(6) 同种异型: 同种不同个体之间的Ig的重链和轻链恒定区上化学结构有微小的差异,这种差异仅表现为个别氨基酸的不同; 如IgG重链恒定区有25种同种异型,称为Gm(1)~Gm(25); IgA重链恒定区有A2M(1)和A2M(2)两种同种异型; K轻链恒定区有Km(1)~Km(3)三种同种异型。
(7) 独特型: 由一种抗原刺激机体所产生的Ig分子只是由某一克隆的B细胞所产生,这种由某一克隆B细胞所产生的Ig分子中可变区的特异性称为Ig分子的独特型。
免疫球蛋白的生物功能 Ig是多功能的蛋白质,既能和抗原结合,又具有其它生物活性。与抗原结合的活性部位在VH和VL,其它生物活性部位在CH上。各类Ig均具有与抗原结合的功能,但是其它生物活性在各类Ig中的表现是不同的。表2是各类Ig生物功能的简解。
(1) IgG: 是第二次免疫反应中出现的Ig主要成分。各类Ig中只有IgG可以通过胎盘,由母体进入胎儿,因此新生儿的抗感染能力以IgG最重要。IgG主要通过经典途径激活补体系统。IgG与补体系统中的C1q的结合部位在CH2功能区。
(2) IgA: 主要是分泌型IgA,存在于分泌液中,如唾液、泪液、初乳、呼吸道分泌液、小肠粘膜分泌液、阴道分泌液等。分泌型IgA在机体局部防御中起作用。血清中的IgA可以通过替代途径激活补体。
(3) IgM: 主要出现在机体的早期免疫反应中,可以通过经典途径激活补体系统。IgM和IgD是淋巴细胞表面Ig的主要成分。
(4) IgD: 特异的生物功能还不十分清楚,机体对某些抗原如胰岛素、青霉素、牛乳蛋白,白喉类毒素、细胞核抗原和甲状腺抗原等所产生的抗体主要是IgD。
(5) IgE: 能与肥大细胞和嗜碱粒细胞结合。在过敏原再次刺激下,与肥大细胞结合的IgE能促使细胞释放一些血管活性物质,如组织胺5羟色胺等,而引起过敏反应。
免疫球蛋白的生物合成和代谢 Ig由B淋巴细胞合成分泌,Ig产生在细胞周期的G1后期和S早期。现在认为Ig分子中的重链和轻链都是由两个基因所控制的,即所谓“两个基因,一条多肽链”。每条肽链的可变区基因和恒定区基因在DNA水平上即融合,然后通过转录和翻译过程合成一条肽链。和其它分泌性糖蛋白一样,Ig分子的多肽链都在粗面内质网合成。合成重链的核糖体的沉降系数是270~300S,合成轻链的核糖体的沉降系数是190~200S。在粗面内质网的侧池内,重链和轻链通过形成二硫键成为Ig单体分子,然后通过高尔基体,分泌囊泡,最后分泌到细胞外。在这一过程中也形成Ig的多聚体,如IgM的五聚体,同时通过转糖酶的作用,不断在Fc上加上糖的成分,寡糖链的起始成分是N乙酰葡萄糖胺,末端是岩藻糖,糖链上的其它成分有甘露糖、半乳糖和唾液酸。
表2人类各类免疫球蛋白的生物功能
| IgG | IgA | IgM | IgD | IgE | |
| 产生顺序 | 2 | 3 | 1 | 4 | 5 |
| 开始形成 | 3月龄 | 4~6月龄 | 胎儿末期 | 较晚 | 较晚 |
| 补体固定 经典途径 | ++ | - | +++ | - | - |
| 替代途径 | + | + | - | - | - |
| 通过胎盘 | + | - | - | - | - |
| 与肥大细胞 和嗜碱细胞 结合 | - | - | - | - | + |
| 与巨噬细胞 和多核细胞 结合 | + | - | - | - | - |
Ig不断被合成与分泌,也不断被分解,各类Ig在体内都维持一定的动态平衡(表3)。
表3 有关各类免疫球蛋白代谢的资料
| 类或亚类 | 血清浓度 (mg/L) | 血浆半寿 期(d) | 转换率 (%d) | 合成率 (mg/kg·d) |
| IgG (均值) | 600~1600 (989) | 14~28 (21) | 4.3~9.8 (6.9) | 20~60 (36) |
| IgG1 IgG2 | 690 … | 21 20 | 8.0 6.9 | 25.4 … |
| IgG3 IgG4 | 50 … | 7 21 | 16.8 6.9 | 3.4 … |
| IgA1 IgA2 | 230 32 | 5.9 4.5 | 24.0 34.0 | 24 4.3 |
| IgM IgD IgE | 100 2.3 0.01 | 5.1 2.8 2.7 | 10.6 37.0 94.3 | 2.2 0.4 0.004 |
IgG的分解代谢受“浓度一分解代谢效应”调节,即IgG的分解代谢速率直接与血浆中IgG浓度有关,血浆中IgG的浓度高时,它的转换率也高,反之亦然。IgD和IgE的代谢也受“浓度一分解代谢效应”调节,但情况与IgG恰相反,即血浆IgD或IgE浓度高时,它们的转换率反而低,血浆浓度低时,转换率高。
免疫球蛋白
免疫球蛋白(Ig)系存在于血浆中的一类具有免疫功能的球蛋白。它们在组成、结构、大小、电荷、生物学活性等方面极不均一。后来在B细胞膜上也发现有这类球蛋白。到目前为止,已发现免疫球蛋白有五大类,即免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白D(IgD)和免疫球蛋白E(IgE)。这五大类Ig虽在基本结构上有相似之处,但在微细结构、理化性质及抗原性方面有所不同。
各类Ig的基本结构是相似的。它们都是由两条相同的较长的肽链(重链)和两条相同的较短的肽链(轻链)通过链间二硫键构成的。轻链可以分成k型及λ型,它们的氨基酸组成及抗原性不同; 重链可分为γ、α、μ、δ及ε五类,它们的氨基酸组成及抗原性也不同。在一个Ig的分子中,两条轻链和两条重链都是相同的,没有混合型的。两条轻链通过二硫键分别与相邻重链连接,两条重链再通过二硫键连接起来。除链间二硫键外,轻链和重链都各自有链内二硫键。轻链有两个,从而构成两个环肽,每环约有60个氨基酸残基;同样,重链有四、五个链内二硫键,可形成四、五个环肽,每环约有60个氨基酸。
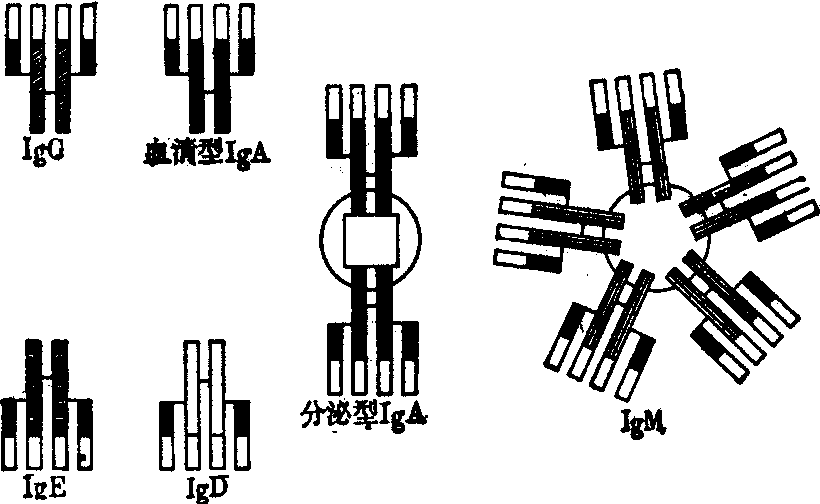
五类免疫球蛋白结构示意图
免疫球蛋白G结构模式图
人免疫球蛋白的理化性质
| 类 别 | 血清中 含量 mg/ml) | 沉降系 数(S) | 分子量 (d) | 糖含量 (%) | 轻链类型 | 重链 类型 |
| IgG IgA(血清型) | 13.2 1.6 | 7 7(9、 11、 13) | 150,000 170,000 | 2.9 9.9 | κ或λ κ或λ | γ α |
| IgA(分泌型) | — | 11 | 390,000 | 11.7 | κ或λ | α |
| IgM IgD IgE | 0.9 0.1 0.00033 | 19 7 8 | 900, 000 184, 000 188,000 | 11.8 13.0 11.6 | κ或λ κ或λ κ或λ | μ δ ε |
免疫球蛋白的构造和分段很复杂。Ig分子中轻链及重链的氨基酸组成的多变部分称为可变区(V区)。通过许多轻链(主要是本周蛋白)的氨基酸组成及顺序的分析,发现每条轻链平均大约有214个氨基酸残基,从N末端起,第1至第107氨基酸是多变的,即在不同轻链的这一段,氨基酸的组成及排列顺序差别很大,因此轻链的这一段即称为可变区,简写成VL (V表示可变,L表示轻链)。IgG的重链约含有446个氨基酸残基,其中也有可变区,即从N末端起第1至第120氨基酸为可变区,简写成VH (H表示重链)。VH及VL构成了Ig的抗原结合部位。以上构造除IgG外,也适于其他Ig,当然有的Ig的重链更长些。在VL区和VH区中,有某些局部区域的氨基酸组成及排列顺序具有更高度的变化。这些高度变化的部位称为超可变区,也称高变区。轻链上常有三个超可变区,即从N末端起的第24~34、第50~55及第89~97氨基酸残基;重链上有四个超可变区,即从N末端起的第30~35、第50~65、第81~88及第95~102氨基酸残基。超可变区与Ig的抗原结合部位有关。比较了许多IgG (主要是多发性骨髓瘤患者的IgG,即单克隆IgG)重链和轻链的氨基酸组成和排列顺序,发现在这些IgG的分子中,重链从第121~446氨基酸,轻链从第108~214氨基酸,它们的组成和排列顺序十分相似,总的来说,不是因人而异,因此重链和轻链的这一段,常称为恒定区(C区),分别以CH和CL表示。这种情况,除IgG以外,也发现在其他Ig的分子上。
人免疫球蛋白的生物学活性

在研究IgG的轻链和重链时,除了发现这两种肽链各有其可变区和恒定区以外,还发现重链的C区可分成三段,这三段的氨基酸组成和排列顺序都很相似,而且与轻链的C区的氨基酸组成和排列也很相似。此外,每一段的长短(即氨基酸的数目)也大致相等,各含大约110个氨基酸残基,其中约有60个氨基酸借助于二硫键构成一个环,每一段肽链(约110个氨基酸残基)还扭屈折叠成一定的构象。于是人们将这每一段称为一个辖区 (或功能区或同系区)。重链的恒定区上有三个辖区,分别以CH1、CH2及CH3表示; 轻链上也有一个与重链相似的辖区,即CL。此外,轻链和重链上还分别有VL及VH两个辖区。每一个辖区,除有严格的构象外,还各有各自的生物学活性。例如,VL及VH辖区共同负责与抗原结合。CH2能与补体结合,CH3能与某些细胞 (如巨噬细胞等)结合,CH1的功能尚不清楚。
其他Ig也都有辖区,但IgM、IgD及IgE的重链各多一个辖区,即CH4。
Ig两条重链CH2区有共同的结构部分称铰链区,也称枢纽区或合叶区。这一区域的氨基酸组成有其特点,即富含脯氨酸。脯氨酸不易构成氢键,因此这区域没有螺旋结构,当与抗原结合时,这区可自由转动,以适应不同距离的抗原决定簇。这一区域易受蛋白水解酶的水解。重链间的二硫键也多集中在此区。如果用木瓜蛋白酶处理Ig,可在铰链区断开,形成Fab和Fc两部分。F为“fragment”的缩写,意为 “分段”,ab为 “antigenbinding”的缩写,意为 “抗原结合”。Fab分段为能与抗原结合的部分,不过它是单价的 (一般抗体都是二价的)。它的分子量约为45,000,由一条轻链和靠N端的半条重链(称为Fd分段)所构成。如经胃蛋白酶水解后形成的分段与Fab不同,胃蛋白酶是从Ig铰链区二硫键的右侧(靠C端)切开,因此其分段为由二硫键连接的含有两个Fab的分段,称F(ab’)2,此外还有Fc的一小部分(此时Fc的大部分都变成小肽或氨基酸)。F(ab’)2能与抗原结合并且是二价的,但无补体结合、细胞结合、穿过胎盘等性能。
Fc分段为Ig分子中能够结晶的部分,C为“crystal-lizable”的缩写,意为“可结晶的”。Fc分段系由两个1/2的重链 (靠C端) 所组成。IgG的Fc分段的分子量约为50,000。各类Ig的特异抗原性决定于其Fc分段。亚类及同种异型也决定于Fc分段上的某一段落。Fc分段无抗体活性,但具有穿过胎盘(指IgG)、结合补体、结合细胞等性质。
Fd分段为Fab分段中来自重链的部分。
免疫球蛋白的生物合成是在浆细胞中进行的。浆细胞核中的DNA将合成Ig的信息转录给mRNA,后者进入胞质到达核糖体,在tRNA的参与下,再将信息翻译成免疫球蛋白。在此过程中,Ig的重链和轻链先分别合成,再连接上糖类物质,装配成Ig,然后从细胞中释出。对于一般蛋白质的生物合成来说,总是一个基因(DNA长链上的一段) 决定着一种蛋白质。免疫球蛋白则不然,是两个基因决定着一个Ig分子的长链或短链。一个基因决定恒定区,另一基因决定可变区。决定恒定区的基因数目有限,决定可变区的基因数目非常大,因此Ig的数目是非常之多的。
免疫球蛋白的结构是千变万化的。这种不均一性反映了抗体形成细胞的遗传差异,而这又是由基因控制的(参见 “免疫球蛋白分子的遗传标志和血清学类型”)。因此Ig结构的变化可作为Ig分子的遗传标志。Ig的血清学类型可有同种型免疫球蛋白、异型免疫球蛋白和独特型免疫球蛋白三大类别。这种区分标志着Ig分子结构在不同水平上的变化,其抗原性也是有所不同的。
免疫球蛋白
immunoglobulin;lg
- 天津松下电子部品有限公司是什么意思
- 天津板栗是什么意思
- 天津林业工具厂是什么意思
- 天津果茶是什么意思
- 天津枸杞是什么意思
- 天津柔道队是什么意思
- 天津栗是什么意思
- 天津核桃是什么意思
- 天津桃花园是什么意思
- 天津桥是什么意思
- 天津桥望春是什么意思
- 天津梅兰日兰有限公司是什么意思
- 天津棉花烤潮所是什么意思
- 天津棉鉴是什么意思
- 天津棒球队是什么意思
- 天津植物志是什么意思
- 天津植物资源是什么意思
- 天津模范小学是什么意思
- 天津橋是什么意思
- 天津橡胶工业研究所是什么意思
- 天津欧娜有限公司是什么意思
- 天津歌声是什么意思
- 天津正大高分子有限公司是什么意思
- 天津正通会计师事务所是什么意思
- 天津武备学堂是什么意思
- 天津武式太极拳研究会是什么意思
- 天津武术组织是什么意思
- 天津民主青年联合会是什么意思
- 天津民俗是什么意思
- 天津民国日报是什么意思
- 天津民国晚报是什么意思
- 天津民立第一小学堂是什么意思
- 天津民立第二小学堂是什么意思
- 天津民航售票处是什么意思
- 天津民航局是什么意思
- 天津民航第23飞行大队是什么意思
- 天津民警报是什么意思
- 天津民间体育是什么意思
- 天津气象铁塔是什么意思
- 天津水上公园是什么意思
- 天津水上运输法院是什么意思
- 天津水师学堂是什么意思
- 天津水师营是什么意思
- 天津水库、鱼洼淀、湖塘鸟类栖息区是什么意思
- 天津水泥工业设计院是什么意思
- 天津水泥灰岩矿是什么意思
- 天津汉高洗涤剂有限公司是什么意思
- 天津汽车夏利股份有限公司内燃机制造分公司是什么意思
- 天津汽车工业进出口公司是什么意思
- 天津汽车工业集团有限公司职工大学是什么意思
- 天津汽车工业(集团)有限公司是什么意思
- 天津河运总兵是什么意思
- 天津油墨股份有限公司是什么意思
- 天津油漆厂是什么意思
- 天津油漆厂武清分厂是什么意思
- 天津沿海的海浪特点是什么意思
- 天津泌尿外科史志是什么意思
- 天津法制报是什么意思
- 天津法律专科函授学校是什么意思
- 天津泥炭矿是什么意思