ROH规则
ROH规则ROH guize
这是判断不同含氧酸酸性强弱的一个简便规则。各含氧酸都可看做是由其原酸脱水而成,如硫酸H2SO4是由H6SO6或S(OH)6脱两个水而成:
S(OH)6→H2SO4+2H2O
各含氧酸都可写成R(OH)m形式,其中R为成酸元素。当R“电荷”(应为形式电荷,即氧化数)越大,半径(应为共价半径)越小时,则R—O之间的引力越大,所成的键越强; 而O—H键相对地越弱,水溶液中越易离解出H+,酸性越强。相反R“电荷”越小,半径越大时,O—H键相对地较强,越不易离解出H+,酸性越弱,甚至显碱性,即为ROH规则。G.H.卡特雷奇将“电荷”和半径结合起来,用离子势φ(Rn+)=n/r(Rn+)(n为R的氧化数,r为离子半径,单位为 10-10m)表示。并发现,若
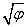 <2.2,则ROH为碱,若
<2.2,则ROH为碱,若❶ 同一周期中不同元素的含氧酸酸性从左至右逐渐增强;
❷ 同一族中不同元素的含氧酸酸性从上至下逐渐减弱;
❸ 同一元素形成几种不同氧化数的含氧酸时,酸性依氧化数递增而递增;
❹有机脂肪酸的酸性随碳原子数递增而递减;
❺ 有机酸的α—碳原子上有吸电子基团取代时,酸性增强; 有排电子基团取代时酸性减弱。
以上结论和实验事实非常吻合,它一直为人们所采用。但这一规则是定性的,不能给出酸的pK值。另外,也没考虑除羟基—OH以外与R直接相连的其他原子的影响,特别是非羟基氧原子的影响,这种影响是不能忽视的。
为此,L.鲍林在研究了含氧酸的强度与其结构关系之后,在其“化学键本质” (1960) 一书中提出了两条经验规则,被称为鲍林规则。
规则1,指出多元酸的逐级电离常数K1,K2,K3…其数值之比约为1:10-5:10-10…,相差105倍。
规则2,根据含氧酸实际存在形态,把含氧酸写成(HO)mROn形式,m为羟基氧的数目,n为非羟基氧的数目。指出含氧酸的K值主要与非羟基氧的数目n有关,近似公式如下:
K1≈105n-7
❶当n=0时,是很弱的酸,K1<10-7;
❷ 当n=1时,是弱酸,K1≈10-2
❸ 当n=2时,是强酸,K1≈103
❹ 当n=3时,是很强的酸,K1≈108
这两条规则不仅给出了含氧酸Ka值范围的判断依据,而且指出非羟基氧是影响Ka值的重要因素,这都是ROH规则所不及的。但鲍林规则不能说明具有相同形式,即具有相同n值不同元素形成的含氧酸的酸性差异,也不能说明有机酸酸性的变化规律。
很多学者试图将ROH规则和鲍林规则表达为经验式,国内有人对(HO)mROnq-n型的含氧酸给出了下述经验式:
pK=7-6n+2m-1+△x+10q
式中△x为氧和R的电负性之差; q为含氧酸所带负电荷数的绝对值,对于一般分子型酸,q等于零。例如,硫酸m=2,n=2,△x=0.9,q=0,按上式计算的pK=-3.1,实验测得的pK=-3.0基本一致。
☚ “8-N”规律 软硬酸碱规则 ☛
- 蔡志忠是什么意思
- 蔡志斌是什么意思
- 蔡志颐是什么意思
- 蔡忠是什么意思
- 蔡忠宝是什么意思
- 蔡忠恕事件是什么意思
- 蔡忠惠集是什么意思
- 蔡忠笏是什么意思
- 蔡忠蕙诗稿帖是什么意思
- 蔡怀新是什么意思
- 蔡思诚是什么意思
- 蔡恒茂是什么意思
- 蔡恢是什么意思
- 蔡悉是什么意思
- 蔡悼侯是什么意思
- 蔡惑是什么意思
- 蔡惟秩是什么意思
- 蔡惠如是什么意思
- 蔡愁洞是什么意思
- 蔡愔是什么意思
- 蔡慕韩是什么意思
- 蔡慧奴的人物故事|评价|小传,蔡慧奴的事迹|史鉴是什么意思
- 蔡慶華是什么意思
- 蔡懋德是什么意思
- 蔡懿德是什么意思
- 蔡戈尼克效应是什么意思
- 蔡成勋是什么意思
- 蔡成勋寓所是什么意思
- 蔡成勳是什么意思
- 蔡成机是什么意思
- 蔡戡是什么意思
- 蔡戡(《全宋词》ⅲ:2018)是什么意思
- 蔡扬名是什么意思
- 蔡承新是什么意思
- 蔡承瀛是什么意思
- 蔡承祖是什么意思
- 蔡拳是什么意思
- 蔡持正是什么意思
- 蔡振是什么意思
- 蔡振华是什么意思
- 蔡振扬是什么意思
- 蔡挺是什么意思
- 蔡挺《喜迁莺》是什么意思
- 蔡捷是什么意思
- 蔡撙是什么意思
- 蔡撙为杨元孙所诉案是什么意思
- 蔡攀龙是什么意思
- 蔡支是什么意思
- 蔡攸是什么意思
- 蔡政文是什么意思
- 蔡敦仁是什么意思
- 蔡敬仁是什么意思
- 蔡敬仲是什么意思
- 蔡敬明是什么意思
- 蔡敬民是什么意思
- 蔡敬襄是什么意思
- 蔡文会是什么意思
- 蔡文华是什么意思
- 蔡文姬是什么意思
- 蔡文姬墓是什么意思