干扰素测定方法
干扰素是具有高度生物活性的细胞产物,能促使细胞产生抗病毒蛋白。下面介绍几种常用的测定方法。
一、细胞病变抑制法
此法操作简便,结果可靠,为许多实验室普遍使用。缺点是不能完全排除判断结果中的主观因素。
(一)试验材料
1.待测干扰素制剂 待测制剂中常含有非干扰素病毒抑制物,因此需要预处理:(1)超速离心处理:100000×g1h;(2)酸处理:先以6mol/LHCl将标本调至pH2,若为γ干扰素,则调至pH3.5,置4℃48~72h,再以6mol/LNaOH调至pH7.2~7.4;(3)热处理:α和β干扰素一般在60℃1h不被灭活,而γ干扰素被灭活。
2.测定细胞 一般应选用同种动物的细胞。如;测定鸡干扰素可用鸡胚细胞,测定猪干扰素可用猪肾细胞。
3.攻击病毒 一般用水泡性口膜炎病毒(VSV)或Sindbis病毒。使用前应在细胞培养中传代增殖,并滴定其TCID50。病毒攻击量一般为100~300TCID50。
(二)操作步骤
1.制备单层细胞培养 测定前一天制备原代细胞或传代细胞,培养24h后长成单层即可使用。
2.用干扰素处理细胞培养 将待测干扰素以含2~5%小牛血清的维持液作2倍递增稀释。轻轻倒去细胞培养液,每瓶加入干扰素稀释液0.5ml。对照组只加维持液。将细胞培养置于37℃培养18~24h。
3.加病毒攻击 用维持液将病毒稀释至100~300TCID50/ml。倾去细胞维持液,每瓶加入1ml病毒稀释液。病毒对照组也接种病毒液,而细胞对照组只换新维持液。37℃继续培养24~48h,取出观察。
(三)结果判定
1.判定标准 在规定时间内(24~72h),首先观察对照组。若病毒对照组各瓶中细胞出现75~100%CPE,而细胞对照组的细胞仍生长良好,即可全面观察。细胞病变保护程度划分为4等,即以“4”表示无明显CPE,“3”表示CPE占25%左右,“2”表示CPE占50%左右,“1”表示CPE占75%左右,“0”表示CPE占100%。
2.判定与计算 干扰素的抗病毒活性以单位/ml表示,有一般判定法和Reed-Muench法。前者国际上最常用。方法是:能保护半数细胞(50%)免受“攻击病毒”损害的1ml干扰素制剂的最高稀释度的倒数即为干扰素的单位/ml。例如,1ml某干扰素被稀释到1∶10000时仍能保护50%的细胞,则干扰素的滴度为10000单位/ml。Reed-Muench法与病毒中和试验中血清中和效价的计算相同。
此法也可在微量细胞培养板上进行。优点是需要的细胞用量少,适于大批干扰素制剂的检测。
二、中性红摄入测定法
活细胞可摄入一定浓度的中性红,并使其着色,而死亡的细胞却不能。两种细胞在分光光度计中的吸光率不同,可借以判定细胞培养的损害程度。此法的优点是结果判定客观、精确和简单,便于大量标本检测。
(一)试验材料
1.中性红原液 配法:(1)2g中性红于乳钵中磨细;(2)加入40ml酒精,调匀使其溶解;(3)加入蒸馏水至200ml;(4)用滤纸过滤;(5)0.5×105Pa高压蒸气灭菌20min,放4℃冰箱保存。
2.脱色液 0.1mol/L NaH2PO4溶液和95%的酒精等量混合(pH4.5)。
3.其余同“细胞病变抑制法”。
(二)操作步骤
1.同“细胞病变抑制法”中的1~3。
2.染色前,倾去病毒液,用生理盐水将细胞单层洗一次。
3.以生理盐水将中性红原液稀释至1∶20000,调至pH7.2~7.4,每瓶加1ml。
4.置37℃1h,将中性红染液弃去。
5.每瓶用生理盐水洗3次。
6.加入脱色液,每瓶2ml,室温放置5~10min。
7.将同一干扰素稀释度的细胞瓶中的脱色液混合,用1~2%NaOH或70℃20min灭活病毒。
8.用分光光度计测定混合液的OD540值,记录读数。
(三)结果计算 有Reed-Muench法和回归直线法两种,前者基本同于中和试验。
1.将干扰素各稀释度之OD值除以正常细胞之OD值,然后乘以100%。
2.将各百分数化为机率单位(Y)。
3.求出回归系数(b)。
4.代入如下公式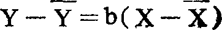
公式中 Y——机率单位
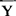 ——机率单位均数
——机率单位均数
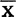 ——干扰素稀释度对数的均数
——干扰素稀释度对数的均数
X——1gED50(半数有效量)
最后查出1gED50的真数即为该干扰素的单位/ml。例如:1gED50=2。295,由反对数表查得真数是200,该干扰素的效价为200单位/ml。
三、空斑形成抑制法
此法较灵敏、精确,结果计算比较客观,但操作较繁,细胞用量多。
(一)试验材料
1.营养琼脂 细胞培养液中含1-2%琼脂,青霉素100单位/ml,链霉素100μg/ml,5%小牛血清,4%1∶1000中性红,3~4%NaHCO3。
2.其余同“细胞病变抑制法”。
(二)操作步骤
1.弃去细胞单层的营养液。
2.每瓶加入2倍递增稀释的干扰素0.5~1.0ml,37℃孵育24h。对照瓶不加干扰素。
3.吸去干扰素液,以Hanks液洗1次,加入50~100PFU攻击病毒,37℃吸附1~2h。
4.弃去病毒液,用Hanks液洗1次。加入含中性红的营养琼脂,37℃继续孵育一定时间后计算空斑数。
(三)结果计算 按中和试验法进行。
四、病毒繁殖抑制法
此法敏感性较高,但操作繁琐,不宜用于大量标本的检测。
(一)试验材料 同“细胞病变抑制法”和“空斑形成抑制法”。
(二)操作步骤
1.同“细胞病变抑制法”中的1~3。
2.收集细胞培养液。
3.用空斑法或细胞病变法测定每组的病毒含量。
(三)结果计算 与对照组比较,以抑制病毒繁殖量50%的干扰素最高稀释度作为其滴度。
病毒的繁殖量也可用血凝或血吸附试验测定。
五、放射化学测定法
用抑制3H尿嘧啶核苷掺入病毒RNA的程度来表示干扰素的抗病毒活性。
(一)试验材料3H尿嘧啶核苷,放线菌素D,三氯醋酸,其余同“细胞病变抑制法”。
(二)操作步骤
1.同“细胞病变抑制法”中的1~2。
2.倾去干扰素液,以Hanks液洗一次。
3.每瓶加入10~25PFU/细胞的攻击病毒,37℃放置30min。
4.每瓶加入5μg放线菌素D,2~3h后换以含3H尿嘧啶核苷的培养液(0.4~1.0μCi/瓶),37℃放置4~5h。
5.倾去培养液,把细胞刮入冰浴中的缓冲盐水中。
6.加入冰冷的5%三氯醋酸,沉淀出酸不溶性物质。
7.将上述液体倾在玻璃纤维滤纸上,沉淀被集中在滤纸上,用三氯醋酸和乙醇洗数次。
8.将滤纸放入液体闪烁计数器中测定其放射性强度。
(三)结果计算 能抑制50%3H尿嘧啶核苷掺入病毒的干扰素量为1个单位。
表24-1将上述方法的某些特性作一比较,以便读者选择时参考。
表24一1 几种测定干扰素方法的比较
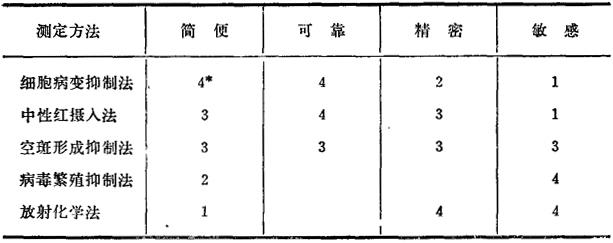
* 4示最好;3示较好;2示较差;1示差。
六、干扰素单位的标准化
干扰素测定受多种因素影响,不同实验室所测得的效价差异往往很大,难以比较。为此,1969年通过国际会议制定了干扰素参考单位,藉此,可以把干扰素单位统一起来。常用的国际标化干扰素可以从美国国立医学研究院(NIMR)或卫生研究院(NIH)索取。
标化干扰素单位的步骤:
(一)测出本实验室的参考制剂的效价与国际标准制剂效价的比值。
(二)未知制剂与本实验室的参考制剂同时滴定,从而算出国际单位。
作为标准的参考干扰素制剂应分装于小安瓿内,冻干保存。
七、影响干扰素活性测定的因素
在干扰素的测定系统中,有三方面的影响因素,即干扰素制剂、攻击病毒和细胞培养。
(一)干扰素制剂 在干扰素制剂中常混有各种污染物质,影响干扰素的测定结果(表24-2)。
表24-2 可能混杂在干扰素制剂中影响其测定结果的因素

(二)攻击病毒 不同的病毒株、攻击量及攻击后读取结果的时间对测定结果都有影响。
(三)细胞培养 不同的细胞系或株、细胞的日龄、细胞的数量、细胞的代谢条件及培养温度等都会影响干扰素的测定。双倍体细胞株对干扰素最敏感,原代细胞次之,传代细胞系最不敏感。日龄较大的鸡胚制备的细胞比日龄较小者敏感。在35~39℃中进行测定结果无差异,4℃时干扰素不能发生抗病毒作用。
- R004939 X线诊断学是什么意思
- R004940 CT原理和医学应用是什么意思
- R004941 CT技术及其临床应用是什么意思
- R004942 临床综合征X线诊断是什么意思
- R004943 放射诊断手册是什么意思
- R004944 临床X线诊断手册是什么意思
- R004945 X线鉴别诊断手册是什么意思
- R004946 放射诊断学(第二版)是什么意思
- R004947 X线诊断基础是什么意思
- R004948 CT诊断学基础是什么意思
- R004949 数字减影血管造影(DSA)的基本原理是什么意思
- R004950 放射诊断学是什么意思
- R004951 实用放射诊断学辞典是什么意思
- R004952 颅脑X线诊断学是什么意思
- R004954 脑血管造影术是什么意思
- R004955 硅肺X线诊断图谱是什么意思
- R004956 包虫病X线诊断学图谱是什么意思
- R004957 颅脑五官X线诊断学是什么意思
- R004958 眼底荧光血管造影释义是什么意思
- R004959 急腹症X线诊断学是什么意思
- R004960 临床泌尿外科X线诊断学是什么意思
- R004961 肝胆胰X线诊断学是什么意思
- R004962 骨与关节X线诊断图谱是什么意思
- R004963 临床消化系统X线读片是什么意思
- R004964 骨关节X线诊断学是什么意思
- R004965 妇产科X线诊断学是什么意思
- R004966 神经疾病CT检查与临床诊疗是什么意思
- R004967 头部CT诊断学是什么意思
- R004968 宫内节育器的X线诊断是什么意思
- R004969 代谢性骨病X线诊断学是什么意思
- R004970 临床体部CT诊断学是什么意思
- R004971 肺部疾病的X线影象及其病理基础是什么意思
- R004972 选择性血管造影术是什么意思
- R004973 骨肿瘤的X线诊断是什么意思
- R004974 肺部疾病的X线病理诊断是什么意思
- R004975 X线诊断学是什么意思
- R004976 消化系X线诊断学基础是什么意思
- R004977 口腔颌面X线诊断学是什么意思
- R004978 周围血管疾病X线诊断及治疗是什么意思
- R004979 胃肠道双对比造影术是什么意思
- R004980 尘肺X线图谱是什么意思
- R004982 实用小儿放射学是什么意思
- R004983 骨伤科X线诊断学是什么意思
- R004984 介入神经放射学是什么意思
- R004985 儿科X线诊断学是什么意思
- R004986 中枢神经系统计算机体层摄影(CT)和磁共振成像(MRI)是什么意思
- R004987 实用胸部X线诊断学是什么意思
- R004988 耳鼻咽喉放射诊断学是什么意思
- R004989 现代野战外科学是什么意思
- R004990 卫生常识是什么意思
- R004991 军队流行病学是什么意思
- R004992 苏联伟大卫国战争医学经验外科部分摘译(1941—1945)是什么意思
- R004993 中国人民解放军卫生防疫工作教范是什么意思
- R004994 中国人民解放军药材供应管理工作教范是什么意思
- R004996 苏联助理军医医学百科手册是什么意思
- R004997 苏联伟大卫国战争期间的医学经验流行病学部分是什么意思
- R004998 苏联伟大卫国战争医学经验内科学部分摘译是什么意思
- R005000 传染病的秘密是什么意思
- R005001 国内外卫生防疫技术发展动态是什么意思
- R005002 战伤自救互救是什么意思