【说明】 根据苛化反应:
Na2CO3+Ca(OH)2 可知,反应是可逆的,苛化过程中,随著反应的进行,NaOH浓度增加,即溶液中的[OH-]逐渐增加,Na↓(2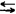 2NaOH+CaCO3/p>
2NaOH+CaCO3/p> 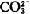 ]逐渐减少。根据共同离子效应理论,Ca(OH)2溶解度越来越低,CaCO3溶解度逐渐上升,当二者溶解度趋向一致时,苛化反应达到平衡,理论的苛化平衡常数K计算如下。
]逐渐减少。根据共同离子效应理论,Ca(OH)2溶解度越来越低,CaCO3溶解度逐渐上升,当二者溶解度趋向一致时,苛化反应达到平衡,理论的苛化平衡常数K计算如下。
【公式】

式中 K——苛化反应理论平衡常数
[OH-]——OH-离子浓度
[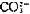 ]——
]——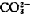 离子浓度
离子浓度
- 雙回門是什么意思
- 雙塔寺雙塔是什么意思
- 雙夾是什么意思
- 雙套飛車是什么意思
- 雙子宫是什么意思
- 雙孔式銅矛是什么意思
- 雙尖是什么意思
- 雙帖是什么意思
- 雙廟是什么意思
- 雙建是什么意思
- 雙弓牀弩是什么意思
- 雙弓米是什么意思
- 雙扇是什么意思
- 雙星是什么意思
- 雙曜是什么意思
- 雙書是什么意思
- 雙月是什么意思
- 雙材是什么意思
- 雙林是什么意思
- 雙林三橋是什么意思
- 雙林寺是什么意思
- 雙枚是什么意思
- 雙柱是什么意思
- 雙柱洋是什么意思
- 雙梢砲是什么意思
- 雙梢竹是什么意思
- 雙樹是什么意思
- 雙款是什么意思
- 雙毫是什么意思
- 雙流紙是什么意思
- 雙涕是什么意思
- 雙清是什么意思
- 雙溪橋是什么意思
- 雙溪草堂書畫録是什么意思
- 雙狐紋雙桃形銀盤是什么意思
- 雙玉薑齋金石圖録是什么意思
- 雙環骨是什么意思
- 雙甄是什么意思
- 雙眼針是什么意思
- 雙睛是什么意思
- 雙碣是什么意思
- 雙立是什么意思
- 雙童洗象玉雕是什么意思
- 雙竹是什么意思
- 雙竹圖是什么意思
- 雙繭是什么意思
- 雙翹是什么意思
- 雙翼帶鋌式銅鏃是什么意思
- 雙耳尖底紅陶瓶是什么意思
- 雙耳房是什么意思
- 雙耳旋渦紋彩陶瓶是什么意思
- 雙耳麻鞋是什么意思
- 雙脊墨是什么意思
- 雙虞壺齋印存是什么意思
- 雙虞壺齋藏器目是什么意思
- 雙虹是什么意思
- 雙虹橋是什么意思
- 雙蛾是什么意思
- 雙蝴蝶是什么意思
- 雙蝶花鈿簪是什么意思