热力学中的基本概念。
在热力学中定义为,S=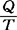 Q为在可逆过程下体系从热源吸收的热量,T为平衡态的温度。熵作为热力学过程可逆性的判据,若始态熵SA,末态熵SB则。
Q为在可逆过程下体系从热源吸收的热量,T为平衡态的温度。熵作为热力学过程可逆性的判据,若始态熵SA,末态熵SB则。
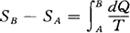
A、B两态均为平衡态,若△S=SBSA=0则过程为可逆的,若△S>0则过程为不可逆过程。
由于积分与路径无关,积分计算可化为可逆过程获得。熵作为过程的判断,总是跟两个状态有关,理论上熵的极大是平衡态,熵等于零是可逆过程,熵大于零是不可逆过程。熵的增加原理是热力学第二定律的另外表述方法,因为熵的增加标明热力学过程是不可逆过程,不可逆过程的普遍存在,正是熵增加原理的客观基础。
熵的微观解释是热力学体系的微观混乱运动的混乱度的标志,从微观认识热力学体系是由大量混乱运动的微观粒子构成。微观粒子总是沿著混乱程度越来越大的趋势发展,直到混乱度达到极大值,即达于平衡态,因此熵增加原理也就是混乱度增加原理。
- 炭场子是什么意思
- 炭坑是什么意思
- 炭块是什么意思
- 炭块儿是什么意思
- 炭块块是什么意思
- 炭块子是什么意思
- 炭基是什么意思
- 炭墨是什么意思
- 炭墼是什么意思
- 炭头是什么意思
- 炭子是什么意思
- 炭将军是什么意思
- 炭將軍是什么意思
- 炭屎是什么意思
- 炭山是什么意思
- 炭山盖是什么意思
- 炭巩子是什么意思
- 炭巴是什么意思
- 炭帽儿是什么意思
- 炭库是什么意思
- 炭库令丞是什么意思
- 炭店乡是什么意思
- 炭店村是什么意思
- 炭或炭火是什么意思
- 炭敬是什么意思
- 炭末沉着病是什么意思
- 炭条儿似的是什么意思
- 炭檛是什么意思
- 炭毛儿是什么意思
- 炭毛子是什么意思
- 炭气是什么意思
- 炭沫沫是什么意思
- 炭河里古城墙和墓葬是什么意思
- 炭泥是什么意思
- 炭渣是什么意思
- 炭火是什么意思
- 炭火堆在他的头上是什么意思
- 炭火盆是什么意思
- 炭火盆扛肩上是什么意思
- 炭灰是什么意思
- 炭灰色是什么意思
- 炭炉是什么意思
- 炭炉架是什么意思
- 炭烤鹿肉串是什么意思
- 炭猴子是什么意思
- 炭甏是什么意思
- 炭画是什么意思
- 炭画纸是什么意思
- 炭疽是什么意思
- 炭疽抗血清是什么意思
- 炭疽护理是什么意思
- 炭疽杆菌是什么意思
- 炭疽沉淀素血清是什么意思
- 炭疽活菌苗是什么意思
- 炭疽病是什么意思
- 炭疽的流行病学是什么意思
- 炭疽福美是什么意思
- 炭疽肺炎是什么意思
- 炭疽芽孢杆菌是什么意思
- 炭皮是什么意思