阿佛加德罗常数的测定
阿佛加德罗常数的测定afujiadeluo changshu deceding
本实验采用电解的方法进行测定。其原理: 用两块已知质量的铜片作阴、阳极,用强度为I(A) 的稳恒直流电电解硫酸铜溶液,经时间t(s)后:
阴极反应: Cu2++2e→Cu (铜片增重mg)
阳极反应: Cu-2e→C2+ (铜片减重m′g)
理论上无副反应时(m=m′)
根据一个铜离子所带电量2×1.6×10-19C,可以导出1mol铜所含原子数:
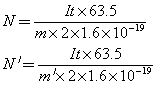
实验步骤: 取3×5cm的薄铜片2块,分别用细砂纸擦去表面氧化物,水洗后用酒精棉球擦净,晾干后精确称重,分别作为阴、阳极;取一100mL烧杯加入约80mL15% (经硫酸酸化) 的硫酸铜溶液,将每块铜片的2/3浸没在硫酸铜溶液中,两块极板间距约1.5cm (见下图)。
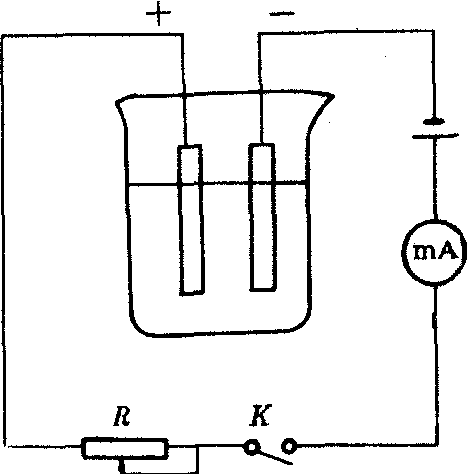
mA: 毫安表 K: 开关 R: 变阻器
电解硫酸铜示意图
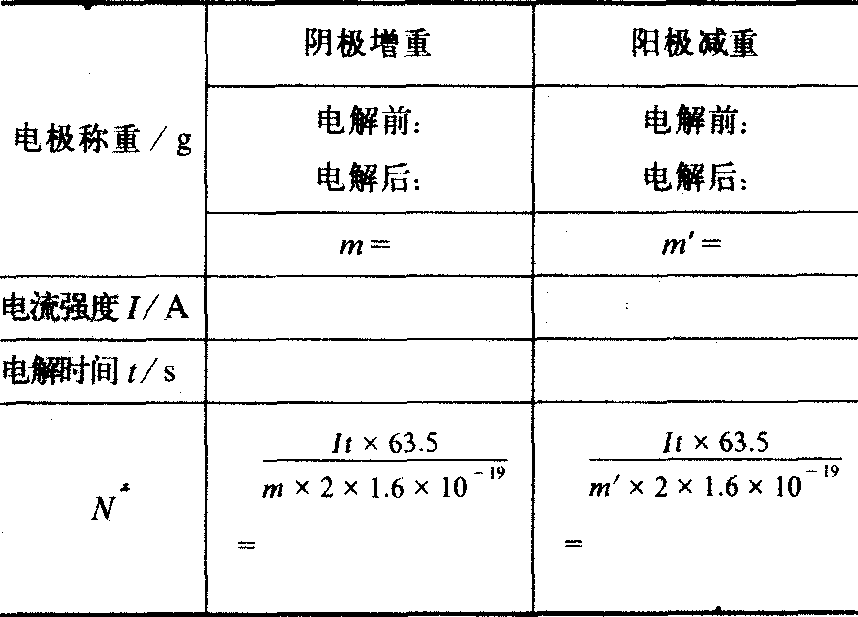
本实验的关键是处理极板洁净,称量精确 (需用分析天平),电流维持恒定。若能确保关键,则本实验所得到的N值比用单分子膜测定的数值精确。
☚ 配合物的形成和性质的实验 食物中铁含量的近似测定 ☛
- 展期是什么意思
- 展板是什么意思
- 展柜是什么意思
- 展演是什么意思
- 展版是什么意思
- 展现是什么意思
- 展眉是什么意思
- 展示是什么意思
- 展缓是什么意思
- 展翅是什么意思
- 展翅高飞是什么意思
- 展翼是什么意思
- 展览是什么意思
- 展览会是什么意思
- 展览品是什么意思
- 展览馆是什么意思
- 展评是什么意思
- 展读是什么意思
- 展转是什么意思
- 展销是什么意思
- 展销会是什么意思
- 展露是什么意思
- 展馆是什么意思
- 屙是什么意思
- 屜是什么意思
- 属是什么意思
- 属下是什么意思
- 属于是什么意思
- 属僚是什么意思
- 属吏是什么意思
- 属员是什么意思
- 属国是什么意思
- 属地是什么意思
- 属垣有耳是什么意思
- 属实是什么意思
- 属性是什么意思
- 属意是什么意思
- 属概念是什么意思
- 属相是什么意思
- 屟是什么意思
- 屠是什么意思
- 屠刀是什么意思
- 屠场是什么意思
- 屠城是什么意思
- 屠夫是什么意思
- 屠宰是什么意思
- 屠宰场是什么意思
- 屠宰税是什么意思
- 屠家是什么意思
- 屠戮是什么意思
- 屠户是什么意思
- 屠杀是什么意思
- 屠格涅夫是什么意思
- 屠苏是什么意思
- 屠门大嚼是什么意思
- 屠龙是什么意思
- 屠龙之技是什么意思
- 屡是什么意思
- 屡屡是什么意思
- 屡战屡胜是什么意思