钢铁的电化学反应
钢铁的电化学反应gangtie de dianhuaxue fanying
取两枚洁净的铁钉,一枚用铜丝紧紧缠绕,一枚用细锌条 (锌片) 紧紧缠烧,分别放入两个培养皿中 (见下图)。另外在一个200mL烧杯中注入100mL蒸馏水,加热至沸,在不断搅拌下加入1g琼脂,继续加热,直至完全溶解。稍冷后向上述溶液中加饱和食盐水5mL,再滴入10滴0.1mol·L-1铁氰化钾溶液和10滴1%的酚酞试液,充分混匀。等液体温度降至温热但尚能流动时,将该混合液倒入上述盛有铁钉的两个培养皿内,并使液面浸没铁钌并高出0.5cm,待其冷却凝固。
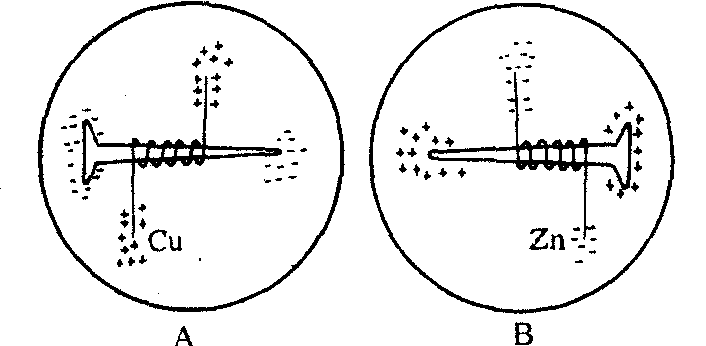
铁钉的电化学反应
静置一昼夜之后可以发现: 在培养皿A中,铁钉的两端出现蓝色,而铜丝的两端出现红色; 在培养皿B中,铁钉的两端出现红色,而锌条的两端出现棕色,现象十分鲜明。解释:
❶在两个培养皿中分别发生不同的电化学腐蚀。
❷在培养皿A中铁钉和铜丝组成了原电池,发生铁钉的吸氧腐蚀。铁钉作负极发生反应: Fe-2e→Fe2+,Fe2+与铁氰根离子结合成蓝色沉淀,其反应式为
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓
铜丝作正极发生反应2H2O+O2+4e→4OH-
所产生的OH-在铜丝两端使酚酞呈红色。
❸在培养皿B中发生了锌条的吸氧腐蚀,锌条作负极发生反应
Zn-2e→Zn2+
Zn2+与铁氰根离子结合成棕黄色沉淀
3Zn2++2[Fe(CN)6]3-=Zn3[Fe(CN)6]2↓
此时铁钉作正极发生反应:2H2O+O2+4e→4OH-
所产生的OH-在铁钉两端使酚酞呈红色。☚ 负催化剂实验 硫元素四种价态的串联实验 ☛
- 山上有山成久客,吏中非吏得空名。是什么意思
- 山上有水,蹇,君子以反身修德。是什么意思
- 山上桂是什么意思
- 山上没有狼,羊子不遭殃; 凉山没有黑彝,娃子不受害是什么意思
- 山上泉水下泻所形成的瀑布是什么意思
- 山上溜冰是什么意思
- 山上滚石头——石打石是什么意思
- 山上滚石头——硬碰硬是什么意思
- 山上滚鸡蛋——没有一个好货(没有一个好的)是什么意思
- 山上王是什么意思
- 山上的世纪是什么意思
- 山上的云是什么意思
- 山上的又一重山是什么意思
- 山上的大石是什么意思
- 山上的小屋是什么意思
- 山上的松柏是什么意思
- 山上的松柏——饱经风霜是什么意思
- 山上的狐狸——又馋又猾是什么意思
- 山上的田地是什么意思
- 山上的石头——久经风霜是什么意思
- 山上的石头,田里的莠草是什么意思
- 山上的竹子是什么意思
- 山上的草木花是什么意思
- 山上的蘑菇是什么意思
- 山上耸立的大岩石是什么意思
- 山上草多花不红是什么意思
- 山上钓鱼是什么意思
- 山上钓鱼——财迷转向是什么意思
- 山上青松陌上尘,云泥岂合得相亲是什么意思
- 山下是什么意思
- 山下十八影是什么意思
- 山下千林花太俗,山上一枝看不足是什么意思
- 山下奉文是什么意思
- 山下孤烟远村,天边独树高原。是什么意思
- 山下律也是什么意思
- 山下旌旗在望,山头鼓角相闻。是什么意思
- 山下汽船剧团是什么意思
- 山下治广是什么意思
- 山下泉是什么意思
- 山下火是什么意思
- 山下跳是什么意思
- 山下跳转体180°是什么意思
- 山下跳转体360°是什么意思
- 山不厌高是什么意思
- 山不厌高,水不厌深是什么意思
- 山不厌高,水不厌深。是什么意思
- 山不厌高,水不厌深。 周公吐哺,天下归心是什么意思
- 山不厌高, 水不厌深。周公吐哺, 天下归心。是什么意思
- 山不厌高,海不厌深是什么意思
- 山不厌高,海不厌深。是什么意思
- 山不在高,有仙则名是什么意思
- 山不在高,有仙则名。是什么意思
- 山不在高,有仙则名; 水不在深,有龙则灵是什么意思
- 山不在高,有仙则名;水不在深,有龙则灵是什么意思
- 山不在高,有仙则名;水不在深,有龙则灵。是什么意思
- 山不在高,有仙则名;水不在深,有龙则灵。斯是陋室,惟吾德馨。是什么意思
- 山不在高,有仙则名;水不在深,有龙则灵。斯是陋室,惟吾德馨。苔痕上阶绿,草色入帘青。谈笑有鸿儒,往来无白丁。可以调素琴,阅金经;无丝竹之乱耳,无案牍之劳形。南阳诸葛庐,西蜀子云亭。孔子云:“何陋之有?”是什么意思
- 山不平处是什么意思
- 山不得是什么意思
- 山不碍路,路自通山是什么意思