酸碱电子论
酸碱电子论suan jian dianzi lun
❶酸、碱的定义1923年G. N.路易斯提出,凡是能给出电子对的分子、离子或原子团都叫做碱,凡是能接受电子对的分子、离子或原子团都叫做酸。例如,在下列反应中:
酸 碱 酸碱配合物
(电子对接受体) (电子对给予体)
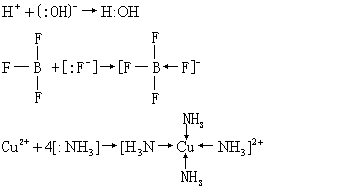
OH- ,F-和NH3都能给出电子对 (式中用“:”表示电子对) ,都是碱; H+,BF3和Cu2+都能接受电子对,都是酸。反应产物H:OH,F3B:F,〔Cu(NH3)4〕2+称为酸碱配合物。
按照电子论的观点,酸碱水-离子论中的典型酸碱都是酸碱配合物。例如,HCl中的H+是酸,Cl-是碱;NaOH中的Na+是酸,OH-是碱,因为:Cl-和: OH-都有未共用电子对。质子论中的碱与电子论中的碱是一致的,如上面列举的Cl-和OH-都是质子论的碱,但质子论的酸,例如HCl,HAc等仍然是酸碱配合物。
电子论的酸碱范围极为广泛,酸碱配合物几乎无所不包。凡金属离子都是酸,与金属离子结合的,不管是阴离子或中性分子都是碱。盐类如NaCl,MgSO4,SnCl4等,金属氧化物如MgO、ZnO,Fe2O3等是酸碱配合物,所有的配合物如 〔Cu(NH3)4〕2+,〔FeCl4〕-,〔Ag(NH3)2〕+等也都是酸碱配合物。不仅无机物是这样,有机物也是这样,例如,乙醇可看作是由乙基离子C2H+5(酸)和羟离子OH+(碱)组成,烷烃类也可看成是由H+(酸)和碳阴离子R-(碱)组成,甚至电子云集中的双键部位也可看做是碱。路易斯提出的电子论定义的酸碱包含的物质极为广泛,因此常把路易斯理论所指的酸碱称为路易斯酸碱或广义酸碱。
❷酸碱反应 下面是几种类型的酸碱反应:
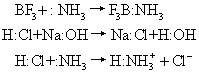
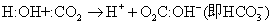
❸酸碱的强度 电子论认为,酸、碱强弱的顺序就是取代的顺序。但是,取代需用某种酸或碱作参比标准,参比标准不同,测出酸碱强度的顺序也可能不同。例如,分别以H+和Ag+酸为参比标准,测定OH-与NH3两个碱的相对强度,实验结果是

可见以H+为标准时,OH-比NH3强,因为OH-可从NH+4中取代出NH3,但是以Ag+为标准时,NH3就比OH-强,因为NH3可从AgOH中取代出OH-形成较稳定的 〔Ag(NH3)2〕+离子。这是广义酸碱反应中的普遍现象,也是酸碱电子论的不足之处。
☚ 酸碱质子论 软硬酸碱 ☛
- 海关规则是什么意思
- 海关规章是什么意思
- 海关规章制度及法令是什么意思
- 海关规费是什么意思
- 海关警告是什么意思
- 海关警察是什么意思
- 海关计征船舶吨税是什么意思
- 海关许可证明书是什么意思
- 海关货品估价公约是什么意思
- 海关货运监管是什么意思
- 海关货运监管对象是什么意思
- 海关辑私部门(英)是什么意思
- 海关过境单据是什么意思
- 海关进出口统计是什么意思
- 海关进口税则是什么意思
- 海关速记员是什么意思
- 海关道是什么意思
- 海关邮政是什么意思
- 海关重量是什么意思
- 海关金单位是什么意思
- 海关铅封是什么意思
- 海关铅封件是什么意思
- 海关限制是什么意思
- 海关限额是什么意思
- 海关风险保证金保函是什么意思
- 海关验货单是什么意思
- 海关验货员是什么意思
- 海兴县(苏基镇)是什么意思
- 海兴阿是什么意思
- 海兵是什么意思
- 海兽是什么意思
- 海兽望月铜镜是什么意思
- 海兽检索手册是什么意思
- 海兽葡萄纹方铜镜是什么意思
- 海兽葡萄纹铜方镜是什么意思
- 海兽葡萄纹铜镜是什么意思
- 海兽资源是什么意思
- 海内是什么意思
- 海内三布衣是什么意思
- 海内三才是什么意思
- 海内东经是什么意思
- 海内八大家是什么意思
- 海内关系是什么意思
- 海内北经是什么意思
- 海内十洲是什么意思
- 海内十洲记是什么意思
- 海内华夷图是什么意思
- 海内南经是什么意思
- 海内名家工画能事是什么意思
- 海内外是什么意思
- 海内外广大地区是什么意思
- 海内外遗珍:世界各地散藏传统绵竹年画是什么意思
- 海内奇观是什么意思
- 海内奇谈是什么意思
- 海内存知己是什么意思
- 海内存知己 天涯若比邻是什么意思
- 海内存知己, 天涯若比邻是什么意思
- 海内存知己,天涯若比邻是什么意思
- 海内存知己,天涯若比邻。是什么意思
- 海内存知己,天涯若比邻。无为在歧路,儿女共沾巾。是什么意思