酸与碱混合后溶液的pH值计算
酸与碱混合后溶液的pH值计算suan yu jian hun-hehou rongye de pHzhi jisuan
酸溶液与碱溶液混合,两者发生中和反应,实质是H+与OH-中和成H2O溶液的体积增加,而H+或OH-浓度大大减少。混合液的体积近似看成混合前各溶液体积之和。如果发生反应无过量物质,溶液的pH值由生成物的性质而定。强酸强碱盐溶液的pH为7; 强酸弱碱盐溶液的pH值小于7; 弱酸强碱盐溶液的pH值大于7(具体计算见“盐的水解计算”)。如果反应有过量物质,过量物质的多少决定了溶液的pH值。
例 1 0.15mol· L-1盐酸溶液 50mL 与0.15mol·L-1氢氧化钠溶液25mL相混合,求混合液的pH值。

答 混合液的pH为1.3。
例2 0.5mol·L-1醋酸溶液和0.2mol·L-1氢氧化钠溶液各100 mL相混,求溶液的pH值。(已知醋酸电离常数Ka=1.8×10-5)
解 CH3COOH+NaOH=CH3COONa+H2O
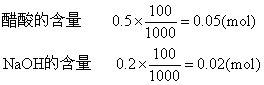
反应剩余的醋酸量 0.05-0.02=0.03 (mol)
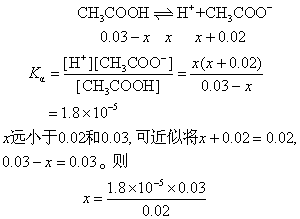
反应生成的CH3COONa为强电解质,100%电离。电离出的0.02 mol CH3COO-参与弱电解质醋酸的电离平衡。设平衡时H+的浓度为x
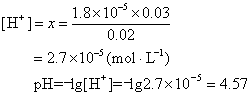
答 溶液的pH值为4.57。
☚ 不同浓度酸或碱混合后的pH值计算 电离度的计算 ☛
- 硬声硬气是什么意思
- 硬壳是什么意思
- 硬壳壳是什么意思
- 硬壳式机身是什么意思
- 硬壳桂是什么意思
- 硬壳硬是什么意思
- 硬壳竹是什么意思
- 硬壳藤是什么意思
- 硬壳虫乌壳虫是什么意思
- 硬壳蛋是什么意思
- 硬壳袄是什么意思
- 硬头是什么意思
- 硬头兵梆是什么意思
- 硬头家伙是什么意思
- 硬头家生是什么意思
- 硬头山是什么意思
- 硬头忤脑是什么意思
- 硬头滑是什么意思
- 硬头米是什么意思
- 硬头船是什么意思
- 硬头货是什么意思
- 硬头路是什么意思
- 硬头雨是什么意思
- 硬头靥是什么意思
- 硬头颈是什么意思
- 硬头饭是什么意思
- 硬头黄是什么意思
- 硬头𮬞子是什么意思
- 硬夺是什么意思
- 硬套是什么意思
- 硬奟奟是什么意思
- 硬娄娄是什么意思
- 硬婩斫是什么意思
- 硬子是什么意思
- 硬字库是什么意思
- 硬宝盖是什么意思
- 硬实是什么意思
- 硬实力是什么意思
- 硬实实是什么意思
- 硬实浪力是什么意思
- 硬寨是什么意思
- 硬寨司是什么意思
- 硬寨太保是什么意思
- 硬对硬是什么意思
- 硬封山是什么意思
- 硬封面是什么意思
- 硬封面版本是什么意思
- 硬将是什么意思
- 硬将一军是什么意思
- 硬尖是什么意思
- 硬尖神香草是什么意思
- 硬展展是什么意思
- 硬山是什么意思
- 硬山儿搁是什么意思
- 硬山房是什么意思
- 硬山搁檩是什么意思
- 硬岔是什么意思
- 硬崖隧道是什么意思
- 硬崩崩是什么意思
- 硬巴巴是什么意思