酶的作用机理
酶何以有如此高的催化效率,这是酶学研究的一个中心课题,不仅在理论上而且在应用上都有重要的意义。按照化学动力学中比较普遍接受的过渡态理论,一个反应的发生总是有一些键断裂和另一些键生成。介于原来键断裂和新键生成的中间状态叫过渡态。反应物的基态和过渡态所处的能量状态不同,这个能量差叫能垒。在一定温度下只有一部分分子的能量能达到能垒顶部的水平,形成过渡态,然后再转变成产物(图1)。当一个反应在酶的参与下进行时,一般要比原来非催化的反应多经历几步,但由于酶与过渡态中间物的紧密结合,稳定了底物处于中间态时结构,降低了底物形成其过渡态所需克服的能垒,结果提高了反应的速度。
近20年来,由于物理有机化学理论的渗透,以及快速反应、X线晶体衍射分析、低温酶学等一系列新技术的应用,使得酶的作用机理的研究有了很大的进展,现在认为酶催化的高效率是由以下许多因素共同作用的结果:
1. 邻近与定向效应:酶与底物结合后,使得底物分子中被作用的键,不但接近于酶的活性部位起催化作用的基团,而且以一定的取向排列,从而更易形成过渡态。图2是这一效应的示意图。A和B两个分子上起反应的基团彼此靠近并有一定取向,提高了起反应的原子间发生碰撞的概率。
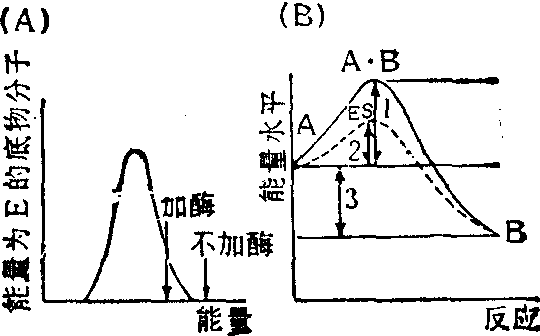
图1 非催化反应和酶催化反应达到过渡态所需克服能垒的比较
(A)在底物分子群的动能分布曲线。箭头表示能起反应分子的最低能量。(B)酶催化反应(虚线)与非催化反应(实线)相比所需能量较低。
2. 微环境效应与多元催化:在酶的活性部位由于局部微环境的影响,使某些酸性基团和碱性基团彼此靠近,或使同一种基团有的带上正电荷,有的带上负电荷,从而发挥了既有酸催化又有碱催化的多元催化作用。例如核糖核酸酶在水解其底物时,第12位和第119位这两个组氨酸分别起着碱催化和酸催化的作用,前者从核糖的2′位羟基上接受一个质子,后者则提供一个质子,与磷酸的氧原子形成氢键。
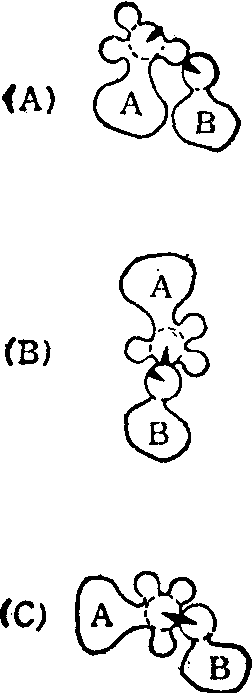
图2 邻近与定向效应示意图
酶分子A和底物分子B上的黑色楔形表示与催化反应有关的部位或基团。二者的空间位置有以下几种情况: (A)既不邻近,也未彼此定向;(B)二者已邻近,但尚未定向; (C)邻近与定向均处于有利状态。
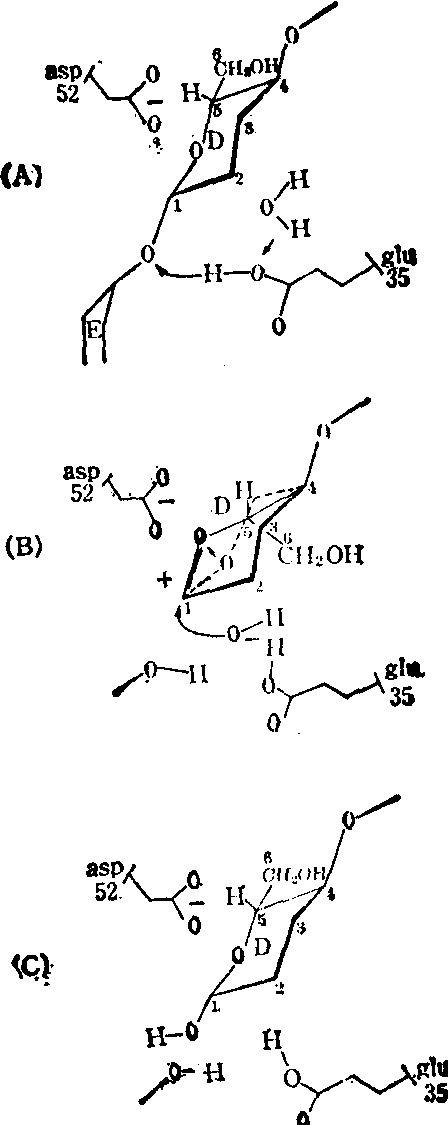
图3 溶菌酶作用过程中底物分子构象变化示意图
图示为底物分子的一部分。D环是N-乙酰胞壁酸的残基,E环是N-乙酰葡糖胺的残基。(A)谷氨酸35的质子攻击两个环间的氧原子。(B)D环1位的C原子变成正C离子,它被邻近的天门冬氨酸52所稳定。D环扭曲为半椅式构型。此时水分子的OH离子对正C离子实施攻击。(C)攻击后导致该处键的断开。
3. 底物的形变:在酶的诱导下,底物分子中被作用的键会产生一定的张力,使结合变弱,因而更易断裂。例如溶酶结合底物后,使底物分子中有一个糖的环发生了扭曲,水解就发生在该处的键上(图3)。这一形变可能使底物结构更加趋近于过渡态中间物的结构,使催化反应易于进行。
4. 酶的构象的变化: 酶与底物的作用是相互的,一方面酶诱导底物发生形变,另一方面底物结合在酶上后也会使酶的构象发生一定的变化,使其活性部位的催化基团与底物分子中被作用的键更好地契合。例如羧肽酶A结合底物后,酶分子就有一个比较大的构象变化。其中第248位酪氨酸移动的距离竟达到酶分子直径的四分之一。这一构象变化使得酶分子中起催化作用的基团与被水解的肽链相互靠近,同时形成了一个疏水性的口袋。加强了底物与酶的相互作用。
- 外债信息管理是什么意思
- 外债偿债率是什么意思
- 外债偿还是什么意思
- 外债偿还度是什么意思
- 外债偿还比例是什么意思
- 外债偿还率是什么意思
- 外债偿还能力是什么意思
- 外债危机是什么意思
- 外债发行是什么意思
- 外债室室长是什么意思
- 外债延期是什么意思
- 外债总额是什么意思
- 外债成本管理是什么意思
- 外债承受度是什么意思
- 外债投向管理是什么意思
- 外债整理是什么意思
- 外债清偿比率是什么意思
- 外债清偿率是什么意思
- 外债率是什么意思
- 外债登记是什么意思
- 外债登记制是什么意思
- 外债登记实施细则是什么意思
- 外债的应计利息和交割金额是什么意思
- 外债管理是什么意思
- 外债管理体制是什么意思
- 外债管理目标是什么意思
- 外债结构是什么意思
- 外债结构管理是什么意思
- 外债统计是什么意思
- 外债统计监测实施细则是什么意思
- 外债统计监测暂行规定是什么意思
- 外债统计监测管理制度是什么意思
- 外债规模是什么意思
- 外债规模管理是什么意思
- 外债负债率是什么意思
- 外债转期是什么意思
- 外债转贷款是什么意思
- 外债重组是什么意思
- 外债风险管理是什么意思
- 外倾是什么意思
- 外倾型是什么意思
- 外倾型择偶心理模式是什么意思
- 外倾思维型是什么意思
- 外倾性格是什么意思
- 外倾情感型是什么意思
- 外倾感觉型是什么意思
- 外倾直觉型是什么意思
- 外傅是什么意思
- 外储是什么意思
- 外储说是什么意思
- 外储说右上是什么意思
- 外储说右下是什么意思
- 外储说左上是什么意思
- 外储说左上(节选)是什么意思
- 外储说左下是什么意思
- 外催是什么意思
- 外傻则是什么意思
- 外像是什么意思
- 外僧巡礼是什么意思
- 外兀歹是什么意思