辐射遗传学radiation genetics
研究辐射的遗传效应的学科。遗传学的一个分支。以1927年美国遗传学家穆勒(H.J.Muller)发表用X射线诱发基因突变的报告为开端,研究电离和非电离辐射对遗传物质直接和间接作用的机理。由物理诱变发展到化学诱变,称之为诱变遗传学(mutagenesisgenetics)。研究对象从微生物到各种高等动植物。应用辐射诱变是育种工作的重要手段之一,对防护辐射危害,保障生物资源与人畜健康,也具有重要意义。
辐射遗传学radiation genetics
系研究电离辐射对微生物、植物、动物和人类遗传作用的规律性的科学。自第二次世界大战后“原子时代”的出现,在人类活动的许多领域里研究、探索、应用原子能,并出现了生物学的新分支学科——辐射遗传学。此学科基本任务是:评价由于人类周围环境中辐射本底的提高而引起的遗传效应,并建立有效措施保护人类的遗传免受辐射作用的损害;评价和防止由于宇宙辐射而引起的遗传效应;制订控制植物、动物、微生物和病毒遗传的新方法,为人类培育更多更好的类型;确定对地球上所有生物类型的遗传影响之特征和大小,以便在辐射本底提高的情况下控制整个生物圈的进化过程。人类的辐射环境包括天然辐射与人工辐射;对生物的效应包括躯体效应和遗传效应;对辐射的遗传效应的定量测定,包括辐射诱发基因的突变、特定位点突变、显性可见突变、辐射诱发染色体畸变;研究辐射对人类遗传性的影响及对人类遗传的危险的评价,近些年这些研究均取得显著成效。
辐射遗传学
又称“放射遗传学”。研究辐射对生物的遗传效应的遗传学分支学科。主要以高等植物为研究对象。
辐射遗传学
辐射遗传学是研究电离辐射对微生物、植物、动物和人类遗传作用的规律性的科学。
Little和Bagg早于1923、1924年就曾以X线诱发小鼠的突变。1927年Muller用CIB染色体[一种带有一个倒位能阻遏交换(C)、一个隐性致死基因(I)和一个棒眼基因(B)的重组染色体]首先在果蝇上成功地获得了辐射对遗传影响的定量资料。以后,Snell (1933)和Hertwig指出,X线照射雄性小鼠的减数分裂后的生殖细胞,会导致显性致死和遗传性半不育(指子代中有半数或半数以上不能成活)。1951年Russell在小鼠上对特定位点的隐性突变和显性可见突变进行研究,为辐射对人类的遗传风险作出了评价。
辐射遗传学的基本任务:
❶外加辐射(核爆炸、放射治疗、放射诊断等)可增加地球上自然环境中的天然辐射量(即本底辐射)。辐射遗传学研究并评价由于本底辐射提高所引起的遗传效应,并建立有效措施,以保护人类的遗传免受辐射作用的损害;
❷评价和防止由于宇宙辐射而产生的遗传效应;
❸制订控制植物、动物、微生物和病毒的遗传的新方法,以便培育更多更好有益于人类的类型;
❹确定辐射对地球上所有生物类型的遗传影响的特征,以便在本底辐射提高的情况下控制整个生物圈的进化过程。
辐射的遗传效应与躯体效应 辐射对人类的影响包括躯体效应和遗传效应两个方面。前者指显现在受照者本人体细胞上的效应,例如放射病、恶性肿瘤等;后者指影响到生殖细胞和后代的效应。辐射的躯体效应不是随机的,其严重程度随剂量而变化,其与剂量间的关系呈S形曲线,有一个最小剂量的“阈值”,低于阈值的剂量便不会出现生物学效应,因此可以提出一个“安全剂量。”而遗传效应就不同,如生殖细胞内的遗传物质受辐射损害时,就可能产生各种各样突变,使婴儿在出生时就患有某种遗传缺陷。由于突变能稳定地从一代传递至另一代,所以,辐射对生殖细胞的遗传效应会在以后的许多代中表现出来。但是,大多数突变(隐性突变)必须夫妇两人都带有相同突变,才能在后代中出现隐性纯合体,因此是随机的。这种遗传效应即使在相当低剂量的照射下,仍可能稍有增加,所以不存在剂量的阈值。辐射遗传效应的直接数据主要从动物实验中得来。哺乳动物包括类人猿和猴类的辐射遗传学研究,为认识人类辐射遗传规律提供了很有价值的知识。同时,还应该注意到辐射遗传的研究,必须从小剂量和慢性照射着手。即使是核武器试验,对地球上总的本底辐射的影响也只是小剂量的。据美国某些人估计,大约需要试验500个氢弹(每个的能量相当于1000万吨三硝基苯酚)才能使地球上的本底辐射量增加一倍。再则,各种辐射用于一系列疾病的诊断和治疗,也使愈来愈多的人受到辐射。这样,受辐射影响的不只是少数人,而是整个地球上的居民。即使小剂量辐射导致遗传变化的比率不很高,但从整个人类考虑时也将成为严重的危险。
特殊环境对人类遗传的影响,也是辐射遗传学的重要课题。宇宙空间的医学生物学研究导致宇宙生物学和宇宙遗传学的建立。早已确定,宇航中的种种因素会诱发果蝇的显性和隐性致死突变以及染色体的互换和不分开;在用小鼠、植物和人体外周血淋巴细胞的实验中,也见到类似现象。诸如对振动和失重这些因素的分析表明,它们能引起遗传学变化。此外,还利用直线加速器、核反应堆和其他电离辐射源研究重粒子对生物遗传的作用。
辐射诱变原理可用来选育微生物和植物的新品种,这称为辐射育种。临床上广泛应用的青霉素、链霉素、金霉素和土霉素等,其菌株都是电离辐射、紫外线或拟辐射物质(氮丙环、芥子气)通过辐射诱变培育而成的。辐射育种所得的一系列近代菌株比天然产量提高数千倍。还可以运用辐射育种的方法改善食品中维生素和其他有价值的成份的质量。也可以通过辐射的作用来改变病原菌和病毒的毒力。
辐射遗传效应的定量测定 遗传效应的定量测定包括两个方面:
❶辐射诱发的基因突变;
❷辐射诱发生殖细胞和体细胞的染色体畸变。
辐射诱发的基因突变 电离辐射诱发的突变效应在很大程度上取决于受照对象的生物学特征和生理条件。例如,细胞核的辐射敏感性取决于细胞周期的特定阶段,以G2期对辐射的敏感性最高。突变频率(作为衡量生殖细胞辐射敏感性的尺度)随下列顺序而递减:精原细胞、精母细胞、精细胞、精子。猕猴和小鼠的资料证明,迅速分裂的B型精原细胞的辐射敏感性最大。在杀死B型精原细胞的剂量下,较少分裂的A型精原细胞并不死亡,从而造成暂时性不育。在杀死所有类型精原细胞的剂量下,则出现完全的不可恢复的不育。例如以250R(伦琴)一次照射人类睾丸即导致暂时性的不育,要12个月之后方可恢复。在一次局部照射性腺的场合下,大约需要500~600R剂量的照射才引起完全不育。
为了详细研究突变的诱发,必须具有关于生物的雄性和雌性配子发生的准确知识。例如,小鼠精子发生(从于细胞转化为成熟的精子)的总延续时间约35天(男人为72~74天)。在细精管中新成熟的精子需要7天左右的时间方能进行射精;若是精细胞则需要7~21天。因此,在照射后一周内受孕的仔窝必来自于受过照射的精子,而在照射后1~3周受孕的仔窝必然来自受过照射的精细胞。对哺乳类,A型精原细胞尤为重要,因为它们的再分裂中包括精原干细胞(As细胞),As细胞则是远期遗传效应的基础。除As外,其他精原细胞类型对辐射都有很高的敏感性。这正是在相当大的剂量照射后出现暂短不育期的原因。
根据对哺乳类卵子发生的研究,在出生后4~5天仍存活的个体中,卵母细胞均处于核网期(见“减数分裂”)。除非卵在照射的12小时之内受精,否则在出生后的任一年龄施以照射,其子代必来自受照的核网期卵母细胞。核网期卵母细胞比生长中滤泡里的卵母细胞要敏感得多。因此,在突变诱发的研究中,主要着眼于最危险的那些时期——精原干细胞和核网期卵母细胞。辐射诱发基因突变的研究大多是在小鼠上进行的,主要的突变类型有:
(1) 显性致死突变: 显性致死突变可使杂合体在胚胎期死亡或在出生后早期死亡。因此可用常染色体显性突变为指标来计算突变率。鉴于一胎所生的子代数目极不一致,目前大多用产前死亡的数据计算突变率。
(2) 特定位点突变: 要检测受过照射的生殖细胞是否发生突变,一个有效的方法就是把一个正常型动物同一个具有几个特定位点的品种杂交,后者有几个明显的特定隐性突变性状,很容易在其子代中把隐性纯合体区别开来。正常型被照射后,如果配子内相应位点的等位基因不发生任何突变,在这种情况下,子代全是杂合体,只能显出正常性状。另一方面,如果正常型动物的配子只要有一个特定位点上的基因由于辐射诱变而发生一个隐性突变,那么,在其子代中必然会出现这一位点隐性基因的纯合体,因而表现该种突变性状,这种隐性纯合体的比例将随突变位点的加多而递增。这种变了样的后裔在断奶期就可很容易被察觉出来,并可以测定其特定基因的突变率。此法的缺点是,实验设计庞大,费用高。
自发突变率是指在自然条件下本底辐射、温度和化学因素等的作用而引起的。据研究,在雄性小鼠每一特定位点的自发突变率为8.1/百万配子; 在雌鼠较低,约1.4/百万配子。在以急性X线照射精原细胞后,诱发特定位点突变的剂量效应不是线性的,而是在大约1000R处出现明显的降低(图1),
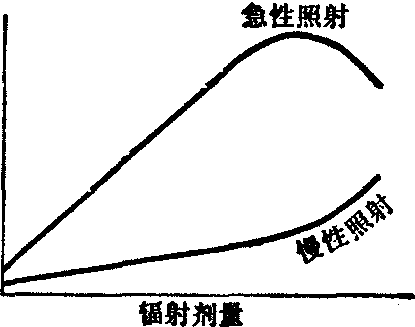
图1 对哺乳类动物作急性和慢性照射后产生的剂量效应
这在裂变中子照射时更为明显。Russell 对此解释为:❶精原细胞在辐射的敏感性上有异质性;
❷导致细胞死亡的这种损伤的敏感性与对突变的敏感性之间为正相关,以致在较高剂量时只有那些对突变的敏感性较低的、具有更大抗性的细胞方能活存下来。发人深思的是,在1000rad(拉德)水平上,相互易位和显性致死突变的频率也比从线性推论的预期值要低。
当以γ线作慢性照射时,特定位点的突变率只有急性照射的峰形曲线的1/4。在较低剂量率下突变频率的减少,可能与细胞内的修复功能有关。在照射强度较大时,这些修复体系由于受到了损伤或“饱和”的缘故,显得不怎么有效,以致突变前损伤中只有一部分可得到修复;可是在较低的照射强度下,修复体系几乎不受到损害,所以突变前损伤中的大部分可成功地得以修复。对于急性X线或γ线照射精原细胞后特定位点突变的剂量效应曲线知道得还不完全,因为迄今研究所用的剂量都低于300R。
已经证实,属于高线性能量转移(LET)的裂变中子对于诱发精原细胞的特定位点突变是十分有效的,它相对于急性X线照射的相对生物学效应(RBE)是5.8,相对于慢性γ线照射的RBE在17~23之间。而且当辐照的强度在79和0.1rad/min之间,未见到剂量率效应,即便照射强度低至0.001rad/min也是如此。
在雌鼠受照的情形下表明,成熟的或正在成熟的卵母细胞中的突变率比精原细胞要低。由此可知,即使人类的未成熟卵母细胞的突变敏感性与小鼠中最敏感的卵母细胞一样,人类受照后,女性的遗传危害也仍将比男性小。
(3)显性可见突变: 显性可见突变的频率很低,但其辐射效应与特定位点突变是相似的。鉴于显性突变的其他类型,如影响到组织亲和性和代谢过程的那些突变较难研究,所以,骨胳的显性遗传变化是研究辐射诱发遗传损伤的一个重要部分。小鼠中发现的许多骨胳异常与人类中罕见的显性和不规则显性遗传病(它们在人类疾病中占有很大的比例)是相似的。因此研究小鼠骨胳突变的辐射效应,可望得到辐射诱发人类显性突变率的独立而直接的估算值。近年来在美国已开始研究辐射诱发小鼠血红蛋白的变型,并且在5个血红蛋白变型中得到了阳性结果。
(4) 隐性致死突变: 通常导致胚胎在生命早期 (大约在植入的时候)死亡的突变,只要检查受孕后期子宫内胎儿便可以察觉。可分为两类,一类是常染色体隐性致死,另一类是X连锁隐性致死。曾经认为“性比”(男孩出生数除以女孩出生数)的改变可用于估计X连锁隐性致死突变的频率。因为如果在X染色体上产生了隐性突变,就会在受照母亲的半合体男性后代 (指全部XY男性后代,因为突变基因只在X染色体上,Y染色体上无相应的等位基因,故称半合体) 上立即表现出来。假如这些突变是致死的,那么男孩出生的数目就会减少,导致“性比”降低。如果产生的是X连锁显性致死突变,则男婴和女婴被排除的机会相等,以致“性比”不变。父方性腺中的X连锁隐性致死基因对“性比”没有影响,而X连锁显性的致死突变将会使活产男孩数增多,以致“性比”升高。换句话说,如果我们研究一个足够大的样本,可以预期在父亲受照的情况下,后代中的“性比”会升高;而在母亲受照的情况下,后代中的“性比”就会降低。可是,事实上,对小鼠的研究,以及对日本广岛和长崎原子弹爆炸幸存者后代的研究,均证明未必如此。这是因为辐射以外的其他许多因素均可能影响到“性比”的变化。例如,父亲(而不是母亲)的年龄会影响到“性比。”出生次序对此也有影响:在第一胎的男孩比率最高,而在以后的出生中就趋减少。此外,在“性比”的研究上,很难选择合适的平行对照也是一个原因。
辐射诱发的染色体畸变 人类体细胞染色体对辐射是非常敏感的,即使所受剂量低至1rad也能察觉,所以是辐射损伤的一个良好指标。研究剂量-效应动力学为在一定场合下推算受照者的剂量提供了一种“生物剂量仪”。
(1) 染色体畸变形成的假说: 关于染色体畸变的形成有两个假说。一是断裂-重接假说,又名“断裂第一”假说,认为畸变的形成主要是当一个辐射粒子(或为“自发的”)通过间期细胞核染色体的连续结构,或是经过染色体附近的时候,直接或间接地引起染色体断裂。这种断裂的趋向不外三种:
❶愈合:即重新按原来的样子相接起来;
❷重接:指与其他断裂片段接成新的结构;
❸依然游离。所以,简单的缺失是由于辐射粒子的一次打击而形成的,称为一击产物:而互换畸变却是由于辐射粒子两次打击所引起的,所以都是二击产物。据研究,人体白细胞的染色体从断裂到重接的时间约为1.5~2小时。可见,只有当二个断裂在时间上较为接近的情形下方能形成互换畸变,这是畸变形成的时间因素。另一个是互换假说:认为所有畸变(包括简单的染色体断裂在内)都是互换过程的结果。在这里,电离辐射引起的原发事件不是断裂,而是在染色体结构上出现一种不稳定状态(其本质尚不清楚)。这种原发损伤或者直接复原,或者进而同另一个原发损伤相互作用,构成互换的“前奏”。第三步才是真正的互换过程,那就是按减数分裂中的交换那样进行。互换假说的一个重要前提是,只有当间期细胞核染色体的螺旋松开并形成一个环(Revell环)时,才能在环内发生互换。畸变的形成还与原发损伤的空间位置有关,这是所谓的“位置概念”。在一个细胞内,只有少数几个位置(有限的空间体积)中的染色体紧密地靠在一起,这些染色体上的原发损伤处于所谓的“重接距离”之内,彼此才可以相互作用。据研究,这一重接距离约为1μm。关于各种染色体畸变的类型,见“染色体畸变”条。
(2) 剂量-效应动力学: 在低LET辐射,人体淋巴细胞的双着丝粒染色体和着丝粒环的诱发主要由两个彼此独立的击中事件所致,只有一小部分是由于一次击中事件所造成,因此剂量-效应动力学符合二次多项模式Y=a+bD+cD2。这里,Y是不对称互换畸变的产额(畸变/细胞),a是自发畸变(畸变/细胞),b是一次击中系数(畸变/细胞·拉德2),c是二次击中系数(畸变/细胞·拉德2),D是剂量(拉德)。所以有显著的剂量-效应。在高LET辐射,一个粒子在单位径迹长度上可释放足够的能量,因此由同一粒子引起的全部断裂在统计上不是独立发生的事件。无论是一击畸变或二击畸变,其剂量-效应动力学主要是线性的关系。所以,当以不同剂量率(那怕相差1000倍)作慢性和急性照射时,畸变的产额没有差别(图2)。
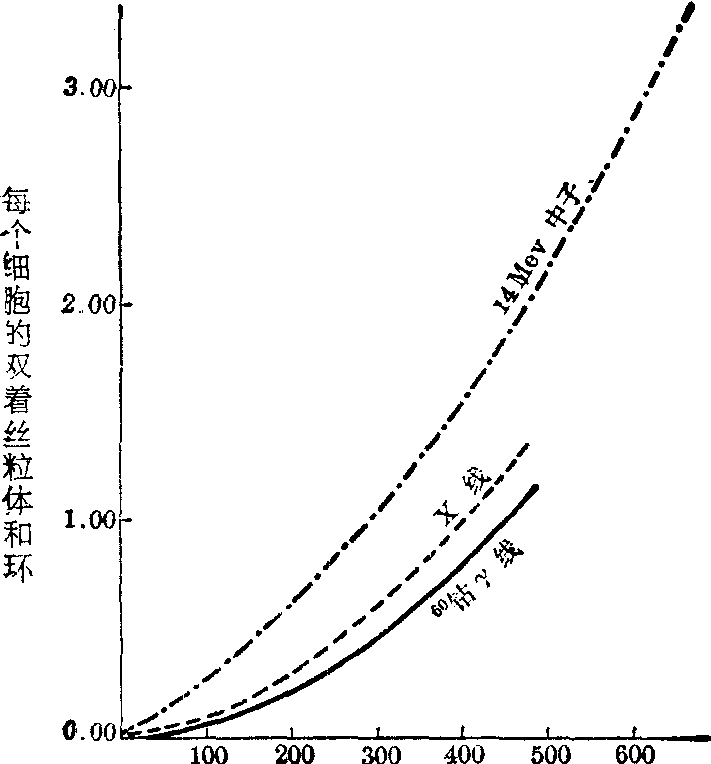
剂 量(rad)
图2 三种辐射照射人体淋巴细胞诱发染色体畸变的剂量-效应曲线
上图是作者等对X线、γ线和14MeV中子照射离体人血淋巴细胞、诱发不对称互换畸变(双着丝粒染色体和着丝粒环)的剂量-效应曲线。人们认为,把离体条件下的剂量-效应曲线用于急性照射下估算生物剂量的范围是1~500rad左右。
Brewen等于1973年根据对6种不同哺乳类的比较研究认为,就双着丝粒染色体的诱发而言,有效染色体臂数为81的人比有效染色体臂数为40的小鼠要敏感二倍,说明在双着丝粒体的产额和有效染色体臂数之间有直接关系,这就是所谓的臂数假说。这一假说曾得到联合国原子辐射效应科学委员会(UNSCEAR)和美国国家科学院电离辐射生物学效应咨询委员会(BEIR)的支持,并进一步假定,人类精原细胞中相互易位的诱发也比小鼠敏感二倍,还以此为据对遗传损伤的危险作出了估计。可是近几年来的研究揭示,臂数假说在现在来看并不如提出时有说服力,而且从体细胞的敏感性推论到生殖细胞这一程序是不可靠的。
用生殖细胞中的染色体畸变来评价辐射的遗传效应有一个优点,即新出现的染色体畸变一般很难在群体中维持下去,充其量只能维持几代:它们的最大效应表现在照射后的第一代,因此比之于显性突变和特别是隐性突变来说,更容易评价其总的后果。
最近的研究证实,由于诊断和治疗的原因而使母亲(特别是高龄孕妇)受到低剂量照射,可能会导致三体型频率的增加。在以γ线照射雌鼠后也会导致染色体不分开频率的增加。
相互易位在人类遗传危害中是一个重要的来源,因为在易位杂合体中会由于减数分裂的分离而导致不平衡产物。自从Evans等于1964年提出用气干法制作哺乳类睾丸的减数分裂标本以来,辐射诱发哺乳类易位的研究相当活跃。在细胞学上观察到的易位与在子一代中见到的“半不育”是相一致的,而前者要方便得多,所以是较常用的方法。X线急性照射小鼠精原细胞诱发易位的剂量-效应关系呈现一种峰形曲线。在剂量为0~400rad之间,易位产额随剂量的增加而上升,符合二次多项模式;可是在500rad以上,易位产额实际上却下降了,这可能是因为在精原细胞中损伤的诱发和在精母细胞中进行观察之间出现了对原发的剂量-效应曲线的破坏。同X线对比,中子诱发易位的相对生物学效应(RBE)约在3~5之间。现在的问题是要确定在所诱发的易位中肯定有害的那一部分易位所占的比率。幸运的是,在辐照后的子一代中预期得的相互易位的频率只有在精母细胞中观察到的1/4,这是由减数分裂过程所造成的。因为减数分裂使每个初级精母细胞产生4个精子。如果精母细胞是相互易位的杂合体,并且分离是正常的,那末在所产生精子中只有一个带有平衡易位,2个是不平衡的,另1个带有正常的平衡基因组。而在子一代中的易位频率实际上约为以上预期的一半。
易位对生活力的影响: 当平衡的易位杂合体和正常型交配时,大约50%的合子将会死去(图3)。随着每个细
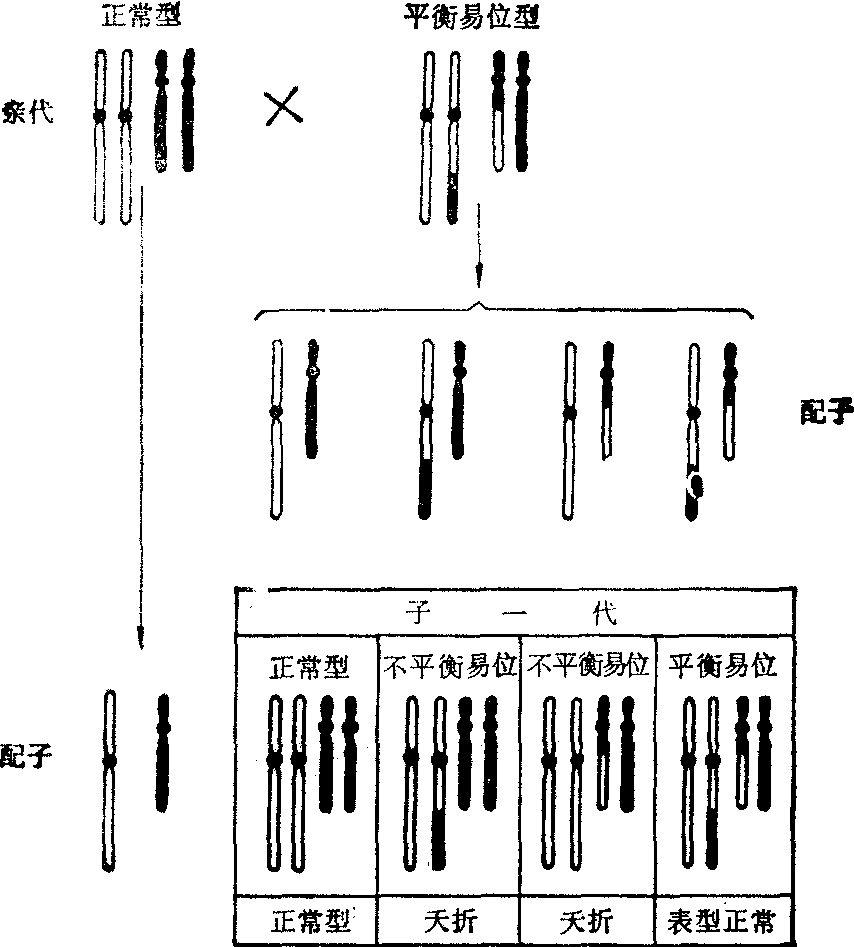
图3 正常型与平衡易位型交配产生的子代类型
胞易位数目的增加,不平衡配子的比率也将增加。因此,对1个易位是杂合的小鼠预期只有50%的子一代是存活的(半不育),而对2个或更多个易位是杂合的小鼠预料其不育的程度将会更高,其后果不再是不育,而是不平衡胚胎的死亡。人类的突变效应 为了估计辐射对人类遗传的影响,必须有人类天然突变过程的资料,以及辐射诱发人类突变率的资料。
由于孕妇接受放射照射后,可能会增加具有异常核型的胎儿数。对生活在印度南部克拉勒海岸高本底辐射地区人群的研究显示,该地辐照量为每年1.53rad(而对照地区为每年0.1rad)。那里21三体型的发病率比对照群体要高得多,21三体型的发生率为0.93/1000(对照地区未见这种患儿)。尽管这方面的资料有待进一步验证,但是,危险是客观存在的,所以对于孕妇的诊断性辐照应尽量减少或避免。
在原子弹爆炸时出现的裂变产物中,对人类关系最密切的是137铯、90锶和14碳。在裂变过程中形成的前二种同位素的半衰期约为30年。对人类生殖细胞的损伤主要由137铯引起,137铯均匀地分布于全身,并发射γ线。90锶沉积于骨胳中,发射β粒子,它们在骨胳内移动的距离约数毫米。90锶沉降到机体内,便可辐射诱发骨癌和白血病。对日本广岛和长崎原子弹爆炸幸存者的研究,虽未证实双亲受照对儿童的死亡率有明显效应,但指出了加倍剂量的下限,相当于在父亲为46rad,在母亲为125rad的γ 线剂量。
辐射对人类遗传危害的评价 遗传危害的评价是指辐射剂量与某些遗传效应频率之间的定量关系。遗传效应的危险度以每单位剂量所诱发的遗传变化(基因突变或染色体畸变)的频率来表示。
性腺剂量、遗传剂量和加倍剂量 性腺剂量是指一个人在经受特殊的辐射检查(诊断和治疗)时性腺所受的辐射剂量,其大小取决于所采用的辐射检查方法。例如,肾X线检查的性腺剂量比胸部剂量要大许多倍。从遗传学的观点出发,性腺剂量通常以一个个体在30年内性腺所受的辐射剂量来表示。
遗传剂量是指整个群体接受的性腺剂量。ICRP(国际放射防护委员会)在以往的建议中规定的遗传剂量极限,在30年期间群体所受附加本底辐射之上的一切辐射源的辐射剂量不得超过5rem(雷姆),此即群体的最大允许剂量。这是一个安全限,它可能远远小于能够在群体中对有害突变的频率产生显著影响的剂量值。
加倍剂量是指使天然的突变率增加一倍所需要的剂量。1966年之前,一般用加倍剂量这一概念来评价辐射的危险。该法的优点是,只要知道了某种突变的自然发生率和诱发率,就可以算出加倍剂量。加倍剂量能在广泛的含义上表达遗传风险。其缺点是, 加倍剂量法的一个前提,即在自发率和诱发率之间应有一定的比例关系,这一论点还有待证实。当剂量与遗传效应的频率之间不是线性关系时,加倍剂量值就没有多大意义。
评价辐射对人类遗传危害的方法 UNSCEAR和BEIR报告分别对辐射的遗传危险作了评价(表1)。其共同特点是:
❶着眼于最危险的生殖细胞阶段,在雄性是精原细胞,在雌性是卵母细胞;
❷鉴于在人类还缺乏直接资料,把实验哺乳类(主要是小鼠)上得到的结果用作危险评价的主要依据;
❸对人类生殖细胞的效应,主要考虑小剂量、高剂量率或慢性的照射条件;
❹用于风险估计的各类遗传损伤的诱发率都是指特定的照射条件下小鼠生殖细胞的效应。要把它们挪用于人类,便需作一定的校正。对于相互易位的诱发,设想人类生殖细胞要比小鼠敏感二倍。
表1 对低LET照射的低剂量率或低剂量照射,每1拉德诱发人类各种遗传损伤的危险
| 终 点 | 由于照射,在每百万配子 中预期的诱发率 | 在第一代 的每百 万人中 的表现 | |
| 精原细胞 | 卵母细胞 | ||
| 常染色体突变 可见的显性突变型 骨 胳 突 变 | 60 很低 4 | — — — | 20 — — |
| 平衡相互易位 不平衡易位产物 | 17~87 34~174 | 低 — | 低 2~10 |
| X染色体丢失 其他染色体异常 | 很低 — | 低 — | 低 — |
(1) 直接法: 小鼠中隐性突变的研究表明,在低剂量和低剂量率时,精原细胞中点突变的诱发率大约为高剂量和高剂量率所观察到的1/3,而隐性致死突变的诱发率至少为1.8×10-4rad-1/配子。为了挪用于人的辐照条件,再将该值除以3即得精原细胞辐照的诱发率,即0.6×10-4·rad-1/配子。在雌鼠虽没有隐性致死诱发的资料,但根据在类似于人类受照的条件下,雌鼠成熟卵母细胞的突变敏感性很低,而未成熟卵母细胞对特定位点突变的诱发实质上也是不敏感的,因此可以想象对雌鼠的危险将是小的。
人类中具有显性效应的突变诱发率的计算:在低LET、低剂量或低剂量率照射小鼠精原细胞导致骨胳异常突变的诱发率为4×10-6·rad-1/配子,而在人类的常染色体显性病(在临床上具有重要意义)中,在不同程度上涉及骨胳者约占10%;另外,小鼠中起源于突变的骨胳异常中约有1/2给人类带来严重疾苦。所以在计算中应估计进去,即为4×10-6·rad-1/配子×10×1/2=20×10-6·rad-1/配子。换言之,当以1rad照射父(精原细胞)后,每百万后代中的20人预期将带有突变,发生显性遗传病。
关于相互易位的诱发已有了更多的认识。易位的辐射风险指的是相互易位而不是罗伯逊易位。对于风险评价有重要意义的诱发率是在子一代中出现的易位。根据精母细胞的资料,减少因子为8,但为了慎重起见,仍假定在子一代中的诱发率是精母细胞的1/4。这样诱发率分别为:0.44×10-4(低剂量X线)、0.87×10-4(低剂量率X线)和0.174×10-4(慢性γ辐照)rad-1/配子。这些都是根据人和狨的细胞遗传学资料并经小鼠中的预期效应校正而得的。如果人类精原细胞的诱发率与猕猴更为接近,则还需给以修正。同时已经知道,在裂变中子照射下,不管是高剂量率或低剂量率,其效应均要高出9倍,所以以上估计值充其量是暂定的。
看来,与相互易位不同,诱发结构畸变的可能性将是非常小的。现在还不能对染色体畸变的其他类型带来的风险作出估算。
(2) 加倍剂量法: UNSCEAR发表的加倍剂量为100rad,是根据Luning和Searle (1971)的资料算得的。当以急性X线大剂量照射诱发小鼠精原细胞的各类遗传损伤时,使点突变加倍所需的剂量范围是16~51rad,平均为30rad;当以慢性照射或很低的剂量率作急性X线照射时,推论诱发率将减少3~4个因子(1因子相当于10%),由此得到雄鼠在这些照射条件下的加倍剂量约为100rad。另一方面,BEIR提出的加倍剂量范围为20~200rad是这样算得的:在低剂量、低剂量率的照射条件下,小鼠的隐性特定位点突变的平均诱发率是0.25×10-7
 rad-1/位点,并假定小鼠特定位点隐性突变的诱发率可挪用于人的各类遗传病,那末将自发率除以诱发率即得加倍剂量为20~200rad。
rad-1/位点,并假定小鼠特定位点隐性突变的诱发率可挪用于人的各类遗传病,那末将自发率除以诱发率即得加倍剂量为20~200rad。关于辐射诱发染色体畸变这一领域还只有零星的知识,当前最迫切的问题是要研究对染色体不分开的诱发:它的数量以及它与年龄和其他参数之间的关系。在这一问题解决之前,还无法确定辐射所造成的染色体损伤的危险同辐射所引起的其他危险(如显性和隐性突变的诱发或肿瘤的产生)相比较,究竟有多大。
现在人类一般接受的加倍剂量为100rad,1rad给群体带来的遗传效应见表2,可以看出:
❶对于简单的显性病和X连锁病,在第一代中预期的增量为平衡时的1/5;病因复杂的疾病之增量为平衡时的1/10;
❷染色体病在第一代的发生率与平衡时几乎相同;
❸在第一代中预期的总增量为,每百万人中有63个新的遗传病病人(占现在发生率的0.06%),在平衡时每百万人中有185个病例(占现在发生率的0.17%)。
表2 在低LET辐射(低剂量、低剂量率)、每代1rad对一个有百万活产儿的群体的效应之估算值 (假定加倍剂量为100rad)
| 疾病类型 | 现在的 发病率 | 每一代1rad的效应 | |
| 第一代 | 平衡时 | ||
| 常染色体显性和X连锁 疾病 | 10,000 | 20 | 100 |
| 隐 性 病 | 1,100 | 较轻 | 增加很慢 |
| 染 色 体 病 | 4,000 | 38 | 40 |
| 先天性异常: 晚期表现的异常结构和 变性疾病 | 90,000 | 5 | 45 |
| 总 计 占现在发病率的百分率 | 105,200 100 | 63 0.06 | 185 0.17 |
BEIR重新计算的数值
| 常染色体显性和X连锁 疾病 | 10,000 | 20 | 100 |
| 隐性病和染色体病 | 10,000 | 较轻 | 增加很慢 |
| 先天性异常: 晚期表现的异常结构和 变性疾病 | 40,000 | 2~20 | 20~200 |
| 总 计 占现在发病率的百分率 | 60,000 100 | 25~40 0.04~0.07 | 125~300 0.21~0.50 |
五十年代把人类的最低加倍剂量10R作为评价辐射对人类的遗传危险的根据。现在,经过20余年研究所获得的资料有力地表明,人类的加倍剂量远远大于10R,在男性约为100rad,而在女性不会低于1,000rad。看来,辐射的遗传效应固然重要,但似乎并不具有压倒一切的重要性。人类在30年期间受到的本底辐射剂量仅约3rem,这一辐射剂量似乎只能说明自发突变率中的3%。显然,人类自发突变中的大多数是由于本底辐射以外的因素造成的。例如环境中的许多化学和物理诱变剂,能穿入细胞,破坏DNA分子。目前周围环境中的各种诱变剂在2,000种以上,这些诱变剂可能给人类的后代带来遗传性缺陷,使每一代人中间都有一定数量的有害突变(即所谓的“遗传负荷”)。因此,遗传学研究的主要任务就是要采用有效的方法,准确地预测环境中特殊诱变剂对遗传的影响,从而进一步控制这些诱变剂。
现在愈来愈清楚,过去建议的遗传剂量的极限是无法达到的。为此,ICRP在1977年的建议书中不再提出群体的剂量极限,而把群体所受的平均剂量当量定为每年不超过0.5mSv(毫希)(即0.05rem),也即在30年期间群体所受的剂量仅为15mSv。
- 杨杏佛是什么意思
- 杨杏佛是什么意思
- 杨杏佛是什么意思
- 杨杏佛是什么意思
- 杨杏佛是什么意思
- 杨杏佛被刺案是什么意思
- 杨村之战是什么意思
- 杨村彬是什么意思
- 杨村彬是什么意思
- 杨村彬是什么意思
- 杨村彬是什么意思
- 杨来兴是什么意思
- 杨杰是什么意思
- 杨杰是什么意思
- 杨杰是什么意思
- 杨杰是什么意思
- 杨杰是什么意思
- 杨杰是什么意思
- 杨杰是什么意思
- 杨杰是什么意思
- 杨杰是什么意思
- 杨杰将军思想研究是什么意思
- 杨杰将军思想研究是什么意思
- 杨松是什么意思
- 杨松是什么意思
- 杨松是什么意思
- 杨松山是什么意思
- 杨松年是什么意思
- 杨松年是什么意思
- 杨松森是什么意思
- 杨松浦是什么意思
- 杨松遭斩是什么意思
- 杨林是什么意思
- 杨林是什么意思
- 杨林是什么意思
- 杨林是什么意思
- 杨林(3)是什么意思
- 杨林永是什么意思
- 杨果是什么意思
- 杨果是什么意思
- 杨果是什么意思
- 杨枝汤是什么意思
- 杨枢是什么意思
- 杨枢是什么意思
- 杨枢是什么意思
- 杨枫是什么意思
- 杨柏森是什么意思
- 杨柏钦是什么意思
- 杨柳是什么意思
- 杨柳不堪藏燕子,淡黄愁杀翠楼人。是什么意思
- 杨柳乱如丝,绮罗不自持。是什么意思
- 杨柳似张绪(灵和柳)是什么意思
- 杨柳依依是什么意思
- 杨柳宫前忽地春,在先惊动探春人。晓来唯欠骊山雨,洗却枝头绿上尘是什么意思
- 杨柳招人不待媒,蜻蜓近马忽相猜。是什么意思
- 杨柳散和风,青山淡吾虑。依丛适自憩,缘涧还复去。是什么意思
- 杨柳映春江,江南转佳丽。吴门绿波里,越国青山际。是什么意思
- 杨柳春是什么意思
- 杨柳未黄莺结舌,委素飘香照新月。是什么意思
- 杨柳枝是什么意思