蛋白质的变性
某些物理、化学因素可以破坏蛋白质分子的空间结构,致使它的理化性质和生物活性也发生显著变化,这种现象称为蛋白质的变性。引起蛋白质变性的物理因素有热、紫外线照射、高压及机械搅拌等,化学因素有强酸、强碱、有机溶剂、脲、胍、去污剂等。蛋白质的变性并不涉及到一级结构的改变,即肽链的共价键并未断裂。由此认为,变性作用的实质是蛋白质分子中某些副键的破坏,从而使蛋白质分子原有的特定空间结构变为无规则而松散。由于副键属于弱键,所以容易被某些物理、化学因素破坏。
蛋白质生物活性的丧失是蛋白质变性的主要表现。所谓蛋白质的生物活性是指蛋白质所具有的酶、激素、抗体、抗原或毒素等活性,以及其他特殊性质,如血红蛋白的载氧能力、肌球蛋白与肌动蛋白相互作用后的收缩能力等。有时,变性蛋白质的空间结构仅有轻微的或局部改变,当这些变化还没有反映到其他理化性质的改变时,已经可以引起生物活性的丧失。因此,在提取制备具有生物活性的蛋白质时,例如酶、激素等制剂时,应避免变性。
蛋白质变性时,某些原来在分子内部包藏而不易与化学试剂起反应的侧链基团,由于蛋白质结构的伸展松散而暴露出来。例如巯基、酪氨酸侧链上的苯酚基、组氨酸上的咪唑基等,因而这些活性基团的反应性可以增强。蛋白质变性后,其溶解度降低,一般在其等电点区域颇易沉淀; 但在碱性溶液中或有尿素、胍等变性剂存在时,则仍保持溶解状态,透析除去这些变性剂后,又可沉淀出来。变性的蛋白质常丧失其结晶能力。球状蛋白质变性后,分子形状亦有所改变,例如蛋白质分子伸展而不对称性增加,表现为粘度增加; 扩散系数降低等。由于蛋白质变性后分子结构伸展松散,则易为蛋白水解酶所分解,所以变性蛋白质远比天然蛋白质易受蛋白水解酶作用。
由几个亚基组成的蛋白质变性后可表现亚基的解聚或聚合,此时每个亚基的构象可能并未改变,但变性程度加深则可使其结构进一步松散。由于各种蛋白质结构的稳定性不同、变性的难易程度亦异。
一般认为,如果引起变性的因素比较温和或在变性的初期,蛋白质分子的构象尚未受深度破坏,则一旦引起变性的因素解除后,仍能使蛋白质空间结构和原有的性质与功能一概恢复原状,亦即变性作用是可逆的。例如,核糖核酸酶用尿素及β巯基乙醇处理后,—S—S—键还原成—SH,氢键受破坏,肽链松散,核糖核酸酶即失去催化功能,成为变性蛋白质。但是,经透析除去尿素与β巯基乙醇以后,—SH基又缓慢地重新氧化成—S—S键,氢键又逐渐形成,因而恢复了原来的空间结构,随之也恢复了酶的功能(图),称为蛋白质复性。然而较强烈的处理往往使蛋白质的变性成为不可逆。例如,受强酸、强碱、加热等处理而变性的蛋白质溶解度降低,生物活性完全丧失。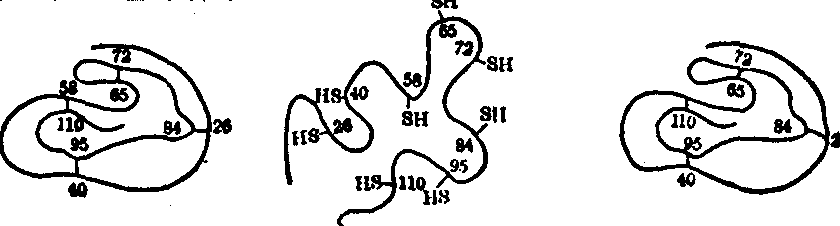
核糖核酸酶的可逆变性
图中的数目是二硫键的位置
蛋白质变性的原理已广泛应用于医学实践。例如,酒精, HgC12、加热
 高压、紫外线等用于消毒、杀菌, 都是使菌体和病毒的蛋白质变性而失去致病性及繁殖能力。
高压、紫外线等用于消毒、杀菌, 都是使菌体和病毒的蛋白质变性而失去致病性及繁殖能力。- 郄昂是什么意思
- 郄枝是什么意思
- 郄疵是什么意思
- 郄祁是什么意思
- 郄穴是什么意思
- 郄竖两面印是什么意思
- 郄缺是什么意思
- 郄萌是什么意思
- 郄蝉草是什么意思
- 郄诜丹桂是什么意思
- 郄诜枝是什么意思
- 郄诜第是什么意思
- 郄門是什么意思
- 郄门是什么意思
- 郄:是什么意思
- 郅是什么意思
- 郅伯夷是什么意思
- 郅偈是什么意思
- 郅寿被诬陷案是什么意思
- 郅居水是什么意思
- 郅恽为友杀人案是什么意思
- 郅恽案是什么意思
- 郅恽的人物故事|评价|小传,郅恽的事迹|史鉴是什么意思
- 郅支是什么意思
- 郅支单于是什么意思
- 郅支单于兼并三国之战是什么意思
- 郅支单于兼并乌揭、丁零、坚昆三国之战是什么意思
- 郅支城是什么意思
- 郅支城之战是什么意思
- 郅支满是什么意思
- 郅支满城是什么意思
- 郅支长是什么意思
- 郅治是什么意思
- 郅都是什么意思
- 郅都案是什么意思
- 郅都苍鹰是什么意思
- 郅都鹰是什么意思
- 郅顺义是什么意思
- 郆是什么意思
- 郇是什么意思
- 郇伯是什么意思
- 郇公厨是什么意思
- 郇厨是什么意思
- 郇家庄白塔是什么意思
- 郇庖是什么意思
- 郇模是什么意思
- 郇珍是什么意思
- 郇瑕是什么意思
- 郇皆是什么意思
- 郇笺是什么意思
- 郇阳是什么意思
- 郇馔是什么意思
- 郇:是什么意思
- 郈是什么意思
- 郈之役是什么意思
- 郊是什么意思
- 郊丘是什么意思
- 郊之役是什么意思
- 郊云驻旌羽,边吹引金钲。是什么意思
- 郊亭是什么意思