蛋白质主链构象的结构单元
蛋白质主链构象的结构单元
蛋白质主链的化学结构主要有
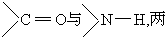
α螺旋 它的结构要素有下列几点:
1. 肽链如螺旋样盘卷前进,螺旋每转一圈,上升3.6个残基,相当于5.44。
2. 每个残基沿轴向上升1.5。
3. 每个残基的N—H与前面隔三个残基的C=O形成氢键,这种氢键就是α螺旋稳定存在的原因(图1)。
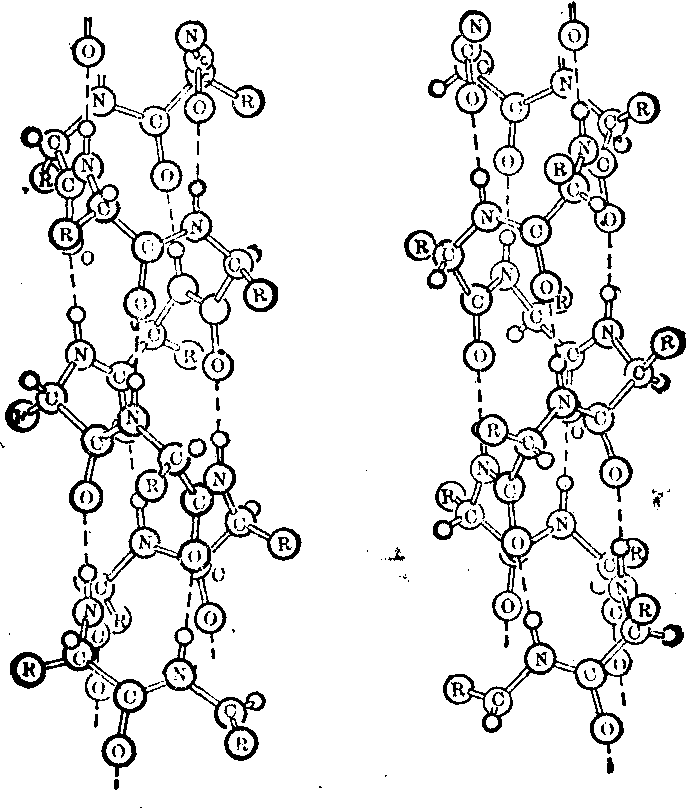
图1 α螺旋的结构图
左边是左手α螺旋,右边是右手α螺旋。虚线表示氢链。注意R的方向,两者的R并不镜面对称。
有两种螺旋,一种是左手螺旋,一种是右手螺旋。从主链看两者是镜面对称的。但侧链的方向不同,相互不完全是镜面对称。在蛋白质中以前报道只发现右手α螺旋。1978年,Roche和Veerdouw在嗜热菌蛋白酶的晶体结构中发现第226~229位残基成左手α螺旋。这是迄今所报道的唯一的左手α螺旋。
早期研究羊毛等角蛋白的X射线衍射图时,英国学者设计了许多模型来解释衍射点,所有这些模型中跳不出整数的概念,即螺旋每上升一圈所包含的残基数是整数。用这种模型产生的衍射点都与角蛋白的衍射花样有距离。此时,美国科学家L. Pauling在精确的键长键角数据的基础上,冲破了整数的概念,作成了每3.6个残基上升一圈的螺旋模型,准确地解释了衍射点。但按照Pauling的模型,每个残基沿轴向上升1.5A,应该有相应的衍射点,而这一衍射点在以前是没有被人所注意的。Perutz在箭猪毫毛的X射线衍射图中找到了这一衍射点,Pauling的α螺旋经受住了考验。在球状蛋白质中存在α螺旋开始是由杨人济和Doty用旋光法加以证明的。后来,在蛋白质晶体结构中“看”到了它。
除图1表示的典型α螺旋之外,还存在着许多非典型的螺旋结构。为了表达这类螺旋结构,规定了一种表示的方法: “ns”。其中n是螺旋每上升一圈的残基数,s是形成一对氢键的O与N两原子间参与共价结构的原子数。如典型的α螺旋中,O与N之间(包括O与N)共有13个原子,如下:
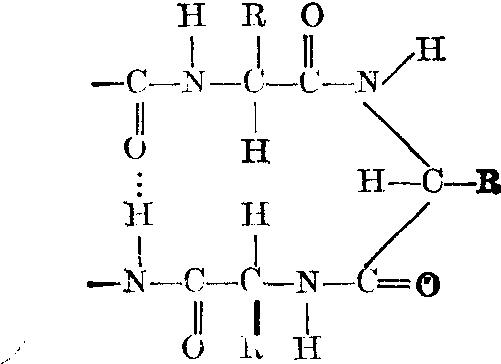
不典型的螺旋如310在蛋白质中也常有发现。此外,在蛋白质晶体结构中发现有另外一种3.613螺旋,它与典型的α螺旋有所不同。典型的α氢键N、H、O三原子处在一直线上,或者与直线偏离不远。 但在非典型的3.61
 中,上述三原子距直线甚远,这样的螺旋从能量看与典型的α相差不大,但要继续形成第二圈螺旋就不可能了。因此在有很多圈螺旋的α结构中,末端一圈螺旋经常形成上述非典型的3.613,如肌红蛋白、胰岛素以及溶菌酶中都有这种例子。这种非典型的α螺旋称为α11,相应地称典型的α螺旋为a1,各种螺旋的重要参数见表。
中,上述三原子距直线甚远,这样的螺旋从能量看与典型的α相差不大,但要继续形成第二圈螺旋就不可能了。因此在有很多圈螺旋的α结构中,末端一圈螺旋经常形成上述非典型的3.613,如肌红蛋白、胰岛素以及溶菌酶中都有这种例子。这种非典型的α螺旋称为α11,相应地称典型的α螺旋为a1,各种螺旋的重要参数见表。不同螺旋的参数

胶原螺旋 胶原的功能主要是保护,它的结构与一般的蛋白质不同。它们的一级结构是隔三个残基近似地重复一次,可以表示成(Gly,Aaa,Bbb)n,第二个残基Aaa中最常出现的是丙氨酸或脯氨酸。从立体看,三条胶原肽链绞合成一个分子。形成这种螺旋时,三条肽链的残基间有一个配对关系。每一条肽链以左手螺旋盘曲,每三个残基盘一图。这个残基的侧链只有一个氢原子,因此体积很小,可靠近三重轴。因此三股螺旋能绞得比较紧。
β折叠 是一种肽链相当伸展的结构。它依靠两条肽链,或一条肽链内的两段肽链之间的C=O与N—H形成氢键而成。两段肽链可以是平行的,也可以是反平行的。前者两条链从“N′端”到“C端”是同方向的,后者是反方向的。从能量看,以反平行为更稳定。
在蛋白质中发现有三段以上的肽链相互并排形成β折叠的。也有只有单独一段肽链伸展为β折叠的,此时称β结构。在蛋白质中出现的β折叠有各种方式的组合,形式十分多样,正反平行也能相互交替。
β转角 蛋白质分子中肽链常会出现180°的回折,在这种肽链的回折角上,就是β转角的结构。如何定义β转角,各家还有些分岐,名词也不统一,如U形转折、链回转、发夹结构等都有人使用,现在逐渐统一为β转角。从结构要素看,有一共同点,就是第一个残基的C=O与第四个残基的N—H形成氢键。
β转角的种类比较复杂,粗分可以有图2所列两种,各称为βⅠ与βⅡ,主要差别是图中Ri+1与Ri+2两个残基间的肽键的空间位置不同。但经分析蛋白质中各种β转角后,许多作者指出可以有十几种β转角。有意思的是其中有一些类别并不需要在1→4残基间形成氢键。可能在蛋白质分子中,有远距离的力在维系整个分子的构象,这些β转角因这种力而得到稳定。
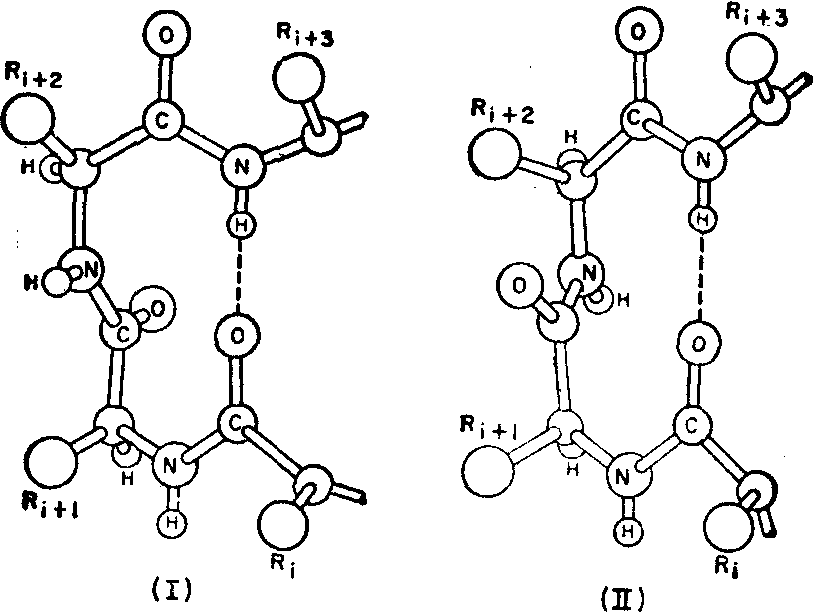
图2 两种最规则的β转角
无规卷曲 没有确定的规律性的那部分肽链的构象称为无规卷曲。
☚ 蛋白质的二级结构和三级结构 蛋白质构象的一般结构原则 ☛
- 食品工业是什么意思
- 食品工业废水及其处理技术是什么意思
- 食品工业技术与质量管理是什么意思
- 食品工厂设计基础是什么意思
- 食品工程原理是什么意思
- 食品工艺学是什么意思
- 食品市场是什么意思
- 食品常用数据手册是什么意思
- 食品广告是什么意思
- 食品广告管制是什么意思
- 食品广告管理办法是什么意思
- 食品微生物学是什么意思
- 食品微生物学检验方法提要是什么意思
- 食品援助是什么意思
- 食品标准大全是什么意思
- 食品标签是什么意思
- 食品标签正误200例是什么意思
- 食品检验与分析是什么意思
- 食品检验技术手册是什么意思
- 食品毒理是什么意思
- 食品毒理学是什么意思
- 食品毒理学是什么意思
- 食品污染是什么意思
- 食品污染是什么意思
- 食品污染是什么意思
- 食品添加剂是什么意思
- 食品添加剂是什么意思
- 食品添加剂是什么意思
- 食品添加剂是什么意思
- 食品添加剂——现状、生产、性能、应用是什么意思
- 食品添加剂分析方法是什么意思
- 食品添加剂手册是什么意思
- 食品物理与化学分析方法是什么意思
- 食品生产经营人员食品卫生培训教材是什么意思
- 食品生物化学是什么意思
- 食品的卫生是什么意思
- 食品的卫生是什么意思
- 食品的忌讳是什么意思
- 食品的营养与食疗是什么意思
- 食品真菌学是什么意思
- 食品科学是什么意思
- 食品纲要是什么意思
- 食品综合体是什么意思
- 食品胶和工业胶手册是什么意思
- 食品色香味化学是什么意思
- 食品营养学是什么意思
- 食品营养局是什么意思
- 食品词典是什么意思
- 食品购销原则是什么意思
- 食品辐照在中国的发展学术讨论会文集是什么意思
- 食品酶学是什么意思
- 食品防腐剂是什么意思
- 食品防腐剂是什么意思
- 食品防腐剂是什么意思
- 食品集是什么意思
- 食品集是什么意思
- 食品雕刻是什么意思
- 食品颜色与分子结构的关系是什么意思
- 食哮是什么意思
- 食哮是什么意思