范特荷甫规则
范特荷甫规则fantehefu guize
温度对反应速率的影响是明显的,或说速率常数随温度的变化率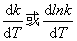 一般是很大的。从19世纪中叶起,就有人逐渐地总结出温度对反应速率影响的各种经验规律。其中J.H.范特荷甫总结出一条半定量的近似规则: 对一般化学反应,温度每升高10K,其反应速率约增大2~4倍,称之为范特荷甫规则。例如,乙酸乙酯皂化反应,35℃时的反应速率为25℃时的反应速率的1.82倍; 蔗糖水解,35℃时的反应速率是25℃时的反应速率的4.13倍。它的数学表达式为
一般是很大的。从19世纪中叶起,就有人逐渐地总结出温度对反应速率影响的各种经验规律。其中J.H.范特荷甫总结出一条半定量的近似规则: 对一般化学反应,温度每升高10K,其反应速率约增大2~4倍,称之为范特荷甫规则。例如,乙酸乙酯皂化反应,35℃时的反应速率为25℃时的反应速率的1.82倍; 蔗糖水解,35℃时的反应速率是25℃时的反应速率的4.13倍。它的数学表达式为

式中 v——反应速率的温度系数
kT——温度为TK时的速率常数
kT+10——温度为(T+10)K时的速率常数范特荷甫规则虽然不很精确,但当数据不足时,用它估算温度对反应速率的影响,仍然是有益的。大部分简单级数反应的速率是符合这一经验规律的。由于它过于粗糙,而且未能反映温度影响反应速率的本质,故一般不常使用。
☚ 反应级数 阿仑尼乌斯公式 ☛
- 葫芦头子戏是什么意思
- 葫芦头泡馍是什么意思
- 葫芦套是什么意思
- 葫芦姑娘是什么意思
- 葫芦娃是什么意思
- 葫芦娃的故事是什么意思
- 葫芦婆是什么意思
- 葫芦子是什么意思
- 葫芦山摩崖石刻是什么意思
- 葫芦岛是什么意思
- 葫芦岛市实华旅行社是什么意思
- 葫芦岛市旅游局是什么意思
- 葫芦岛市红绿蓝旅行社是什么意思
- 葫芦岛市青年旅行社是什么意思
- 葫芦岛市黄金假日旅行社是什么意思
- 葫芦岛市(龙港区)是什么意思
- 葫芦岛港是什么意思
- 葫芦岛筑港开工纪念碑是什么意思
- 葫芦岛钢管总厂新疆联营厂是什么意思
- 葫芦峪是什么意思
- 葫芦崇拜是什么意思
- 葫芦已成瓢是什么意思
- 葫芦巴药方是什么意思
- 葫芦幻是什么意思
- 葫芦庙是什么意思
- 葫芦形彩陶瓶是什么意思
- 葫芦形收缩是什么意思
- 葫芦形胃是什么意思
- 葫芦念作是什么意思
- 葫芦掉井里是什么意思
- 葫芦掉进深井里——不沉(成)是什么意思
- 葫芦掉进深井里——假深入是什么意思
- 葫芦提是什么意思
- 葫芦搅茄是什么意思
- 葫芦搅茄子是什么意思
- 葫芦是吊大的,孩子是哭大的是什么意思
- 葫芦是吊大的,小孩是哭大的是什么意思
- 葫芦晃悠悠是什么意思
- 葫芦晚了季节——没长出嘴来是什么意思
- 葫芦有藤,话有根是什么意思
- 葫芦条儿是什么意思
- 葫芦枕头是什么意思
- 葫芦枣是什么意思
- 葫芦样是什么意思
- 葫芦格是什么意思
- 葫芦案是什么意思
- 葫芦沟遗址是什么意思
- 葫芦河是什么意思
- 葫芦河污染治理是什么意思
- 葫芦瀑是什么意思
- 葫芦照样是什么意思
- 葫芦牵到扁豆藤是什么意思
- 葫芦王是什么意思
- 葫芦王地是什么意思
- 葫芦瓜是什么意思
- 葫芦瓢是什么意思
- 葫芦瓢——里虚是什么意思
- 葫芦瓢捞饺子——汤水不漏是什么意思
- 葫芦瓤子是什么意思
- 葫芦的传说是什么意思