肌肉蛋白质
蛋白质在肌肉中约占湿重的20%,是构成肌肉的主要固体物质。肌肉中的蛋白质按其作用大致可分为基质蛋白质、细胞蛋白质和肌原纤维蛋白质三组。
(1) 基质蛋白质: 是肌肉组织中完全不溶的,惰性的结构成分,如细胞外的胶原及弹性蛋白等。它们负责把肌纤维连成整块肌肉,固定肌肉中的各种结构,还可将肌纤维所产生的张力传送至肌键。这组蛋白质约占肌肉总蛋白质的1/5。
白质: 为一般细胞所共有的蛋白质。包括代谢过程所需要的酶体系以及具有特定功能的核蛋白、糖蛋白及脂蛋白等。这组蛋白质亦占1/5左右,其中溶解在肌质中的总称为肌溶蛋白,主要包括参加糖酵解过程的酶体系及肌红蛋白等。用冷水可将其提取出来。其余的分布于一定的微细结构中,用冷水不能提取。
(3) 肌原纤维蛋白质: 肌原纤维是肌肉收缩的基本单位,由粗、细丝构成,其主要成分都是一些不同的蛋白质。
构成粗丝的蛋白质 构成粗丝的蛋白质主要为肌球蛋白,此外还有少量的C蛋白质及M蛋白质。
肌球蛋白 又称肌凝蛋白。占肌原纤维蛋白质总量的54%,占肌肉组织蛋白质总量的34~45%,可用0.6mol/LKCl提取,若将提取液稀释或透析则可沉淀析出,如此反复数次可获得肌球蛋白纯品。肌球蛋白的分子量为460,000,旋转投影电子显微镜图显示其分子形状似黄豆芽: 由双椭球形的头及长杆状的尾构成 (图1)。兼有球形及纤维形蛋白质的性质。
肌球蛋白的生物学功能:
❶肌球蛋白溶液在生理pH及离子强度下可自发聚合成丝状结构。
❷肌球蛋白具有ATP酶活性,可催化ATP水解释放末端磷酸基及能量。这里所释放的化学能在肌肉收缩时转变为机械功。快肌的ATP酶活性大于慢肌、心肌及平滑肌。
❸肌球蛋白可与肌动蛋白结合生成肌动球蛋白。肌动蛋白是肌原纤维细丝的主要成分。
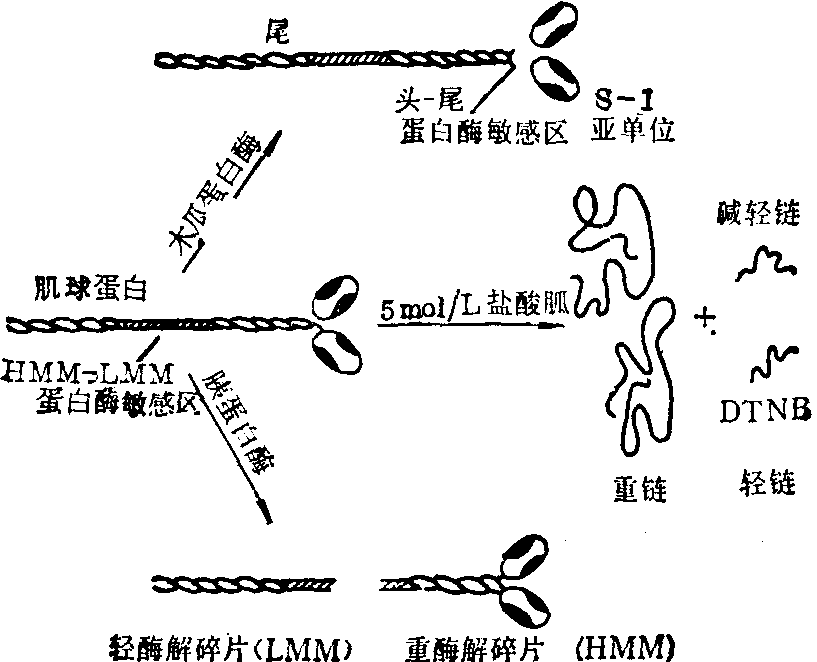
图1 肌球蛋白分子结构
对于肌球蛋白的结构及结构与功能的特点简述如下:
(1) 氨基酸组成的特点: 骨胳肌肌球蛋白的组成氨基酸近1/3为酸性氨基酸(谷氨酸22.1%,天冬氨酸8.9%),1/5为碱性氨基酸(赖氨酸10.3%,精氨酸7.0%,组氨酸1.7%)。其含硫氨基酸的2/3为蛋氨酸,1/3为胱氨酸及半胱氨酸。此外,尚含有三种稀有的甲基化氨基酸,快肌肌球蛋白的重链中含有一个N3甲基组氨酸残基,而慢肌中则无。再者,肌球蛋白分子的头部含有ε,N单甲基赖氨酸及ε,N三甲基赖氨酸。甲基化赖氨酸占赖氨酸总数的4/170,甲基化组氨酸占1/35。它们对肌球蛋白分子的功能可能有某种特殊作用。
(2) 肌球蛋白分子的亚单位组成: 在变性剂的浓溶液中(如5mol/L盐酸胍或尿素)肌球蛋白分子的非共价键遭到破坏而分离成6个亚单位: 2条重键及4条轻键(图1)。一级结构的研究表明两条重键十分相似,在某些肌肉甚至相同。每条重键的分子量为200 000,由1750个氨基酸残基组成。其中N末端的一半折叠成为球形的头部; C末端的一半卷曲成右手α螺旋。两条重链的α螺旋部分互相缠绕形成杆状的尾部。四条轻链均存在于头部。根据使其与重链分离的处理方法而分为两类,即DTNB轻链及碱轻链。每个头各有一个DTNB轻链和一个碱轻链。DTNB轻链的分子量为18 000,含有2个SH基。可能与Ca2+对收缩过程的调节有关,故DTNB轻链又称调节轻链。另一类轻链可通过升高pH而将之分离,故名碱轻链。有证据表明其存在为肌球蛋白ATP酶活性所必需,故又称必需轻链。碱轻链有A1及A2两种类型,分子量分别为20 700及16 500,其一级结构有很大的相似性。每个肌球蛋白分子的两个头所具有的碱轻链是同一类型的。不同类型的碱轻链存在于不同的肌球蛋白分子中,形成同功酶亚群。快肌、心肌、慢肌的肌球蛋白其碱轻链的SDS凝胶电泳图谱不同,而DTNB轻链则同。
(3) 肌球蛋白的蛋白酶水解碎片 (图1): 肌球蛋白分子有两个区域对蛋白酶的水解特别敏感。用胰蛋白酶或糜蛋白酶短暂的处理肌球蛋白,则在其尾部近中心处肽键断裂,产生二个大小不等的碎片: 轻酶解碎片(LMM)和重酶解碎片 (HMM)。LMM的分子量约为150 000,来自两条重链的C末端部分。其在生理离子强度下可自发的聚合成丝而从溶液中析出; 但没有ATP酶活性;亦不具备与肌动蛋白结合的能力。HMM的分子量约为350 000,包括两条重链的N末端部分及四条轻链。具有ATP酶活性及与肌动蛋白结合的能力; 但不具有自相聚合或与LMM聚合的倾向。HMM可进一步被木瓜蛋白酶水解产生两个球形的亚段(称为HMM S-1)及一个杆状的亚段(称为HMM S-2)。两个HMM S-1的分子量分别为120 000及180 000,每个HMM S-1相当于一个头,含有一个ATP酶活性部位及一个肌动蛋白结合部位。HMM S-2的分子量约为60 000,其长度为37μm,全部为双股α螺旋,与LMM共同构成肌球蛋白的尾部。但其与LMM不同的是没有聚合能力,在生理离子强度下是可溶的。
(4) 肌球蛋白组装成粗丝: 前已述及,无论是整个肌球蛋白分子,或是其酶水解碎片: LMM或去头的整个杆状部(LMM+HMM S-2),在生理pH及较低离子强度(0.17mol/L KCl)下均可自发聚合成丝状。这些丝状物的长短不均一。骨胳肌的天然粗丝约由300~400个肌球蛋白分子按有序的定向排列组装而成,即分子的尾端朝向粗丝的中心,头端朝向两端,中心两侧肌球蛋白分子的方向相反 (图2)。各肌球蛋白分子的LMM部分平行聚合成粗丝的主干。中段(150~200nm) 没有横桥 (头部),这段区域相当于暗带中的亮区。各肌球蛋白分子的头部好似螺旋浆的叶片从粗丝的侧方伸出,规则的在粗丝的表面排成六行。每行上的头分别与一条细丝的肌动蛋白作用,因而每条粗丝可与周围的六条细丝相互作用产生张力。从粗丝表面伸出的头在同一行中间隔的距离为42.9nm; 沿粗丝的长轴每隔14.3nm可能有一对或二对或3个头伸出(图3)。在粗丝的每一横切面上一般有18个肌球蛋白分子参差并列成束。
(5) 肌球蛋白的ATP酶活性: 每个肌球蛋白分子有两个ATP酶活性部位,分别存在于每一个HMM的S-1亚段中。在S-1亚段中有两组-SH,它们对烷化剂的敏感性不同,所起的作用亦不同。若封闭较敏感的-SH,
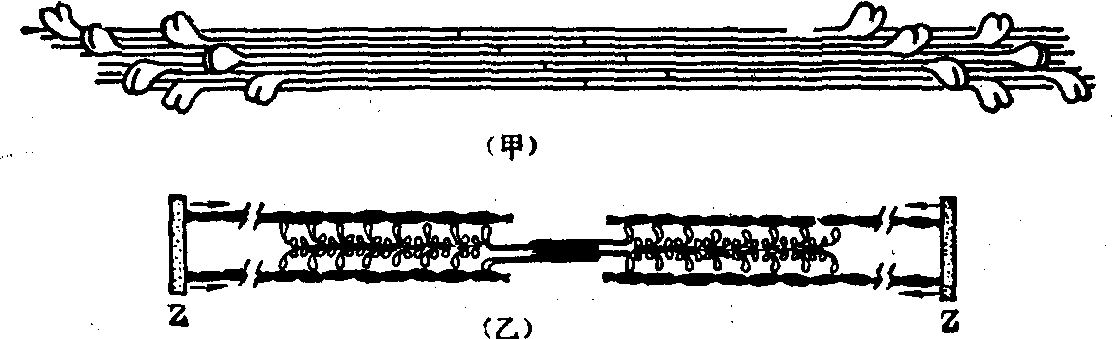
图2 肌球蛋白粗丝组装模式图
甲: 肌球蛋白聚合成粗丝,头部朝向两端,粗丝显示双极性
乙: 粗丝与细丝的相互关系
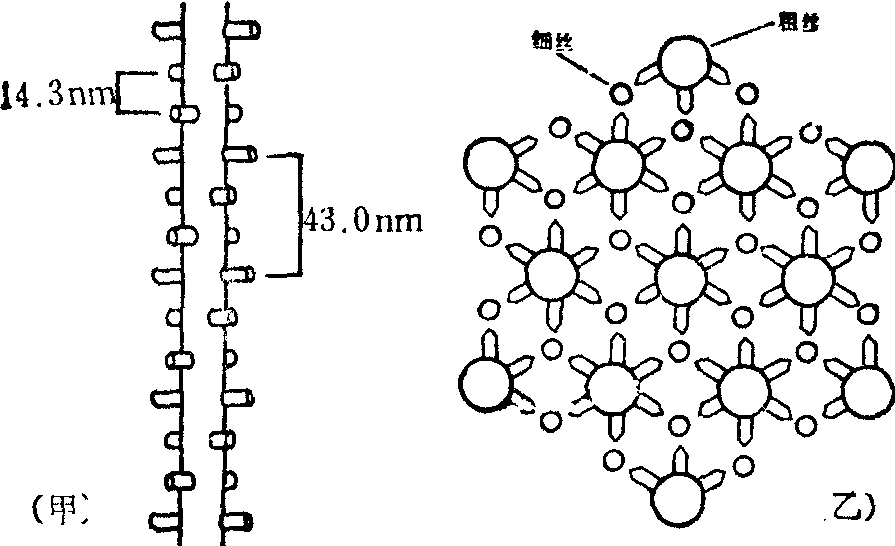
图3 粗丝横桥的排列(模式)
甲:沿粗丝长轴每隔14.3nm有一对肌球蛋白分子的头(横桥)向外伸出
乙:每条粗丝的周围有6条细丝,每条细丝与一个横桥相对应。
则ATP酶活性增加,这表明这些-SH对ATP酶有抑制作用; 若封闭较不敏感的-SH,则ATP酶活性完全丧失,这表明其为ATP酶的必要基。从肌球蛋白分子的头端已分离出一种能结合ATP—Mg2+的8肽。它含有一对ATP酶活性所必要的半胱氨酸残基。Ca2+、Mg2+及肌动蛋白均显著影响肌球蛋白ATP酶活性。一定浓度的Ca2+对肌球蛋白ATP酶有明显的活化作用。过高浓度的Ca2+则有抑制作用。Mg2+对体内绝大多数酶有活化作用,唯对肌球蛋白ATP酶有强烈的抑制作用; 然而,当肌动蛋白与肌球蛋白结合后,ATP酶活性增强100~200倍,同时Mg2+的影响亦由抑制转变为活化。
C蛋白质 占粗丝总量的2.5~3.5%,分子量为140 000,长度为35nm,为一条单链多肽折叠而成。α螺旋的含量很低,β折叠及不规则卷曲各占50%。在生理离子强度下与肌球蛋白或其LMM片段有很强的结合力,指明其与粗丝的骨架而非突出的横桥发生作用。C蛋白质在天然的粗丝表面形成14个等间隔的横带,因而推测其功能是做为一把“钳子”将肌球蛋白分子束加固。
M线蛋白质 在每一个肌节暗带的亮区有一条暗线(M线)。经高分辨显微镜研究证明在粗丝的M区存在一些精细结构: M丝及M桥。M丝的直径为5~6nm,与粗丝平行贯穿M区。M桥围绕M区粗丝呈放射状排列,并与M丝连接形成网状结构。用低离子强度的溶液短时间提取即可把M线物质与肌原纤维的其他收缩装置分离。在M线物质中含有蛋白质复合物,现已分离出二种蛋白质,一种是M蛋白,分子量为165 000,可能是M丝的组分,与肌球蛋白有很高的亲和力,只存在于骨胳肌及心肌中,不存在于平滑肌及大多数非肌细胞中。另一种为MM肌酸激酶,分子量为88 000,在6mol/L盐酸胍中可解离成二个相同的二聚体,这种MM肌酸激酶可能兼有酶的及结构的功能。
构成细丝的蛋白质 细丝的直径为6~8nm,长度为2μm。其骨架是由球形亚单位构成的双股螺旋。原肌球蛋白及肌钙蛋白作为调节蛋白质参加细丝的构成。α辅肌动蛋白及β辅肌动蛋白则分别在细丝的两端与其固定及长度控制有关。
肌动蛋白 肌动蛋白又称肌纤蛋白,以球形的单体(G肌动蛋白)及纤维形的多聚体(F肌动蛋白) 两种形式存在。G肌动蛋白的分子量为42 000,由一条α螺旋占29%的单链多肽卷曲成近球形 (5.5nm×3.5nm×5.0nm)。等电聚焦分析证明肌动蛋白有三种类型。它们的分子量相同而等电点不同。等电点最低的α肌动蛋白主要存在于心肌及骨胳肌的肌原纤维中,β肌动蛋白及等电点最高的γ肌动蛋白主要存在于非肌细胞的胞质中,二者的比例因组织而异,γ肌动蛋白还存在于平滑肌中。对肌细胞而言,在肌原纤维及肌质中至少存在着两种肌动蛋白。兔骨胳肌肌动蛋白的一级结构已完全查明,是-条含有374个氨基酸残基的多肽链。其中包括15个胱氨酸残基,因而其α螺旋结构还不到三分之一。肌动蛋白N端肽段含有较多酸性氨基酸残基,此肽段的氨基酸残基是可变的区段。等电点不同的三种肌动蛋白在氨基酸残基顺序上的差别常在此。等电点低的骨胳肌及心肌肌动蛋白在N末端的前五个氨基酸残基中有四个是酸性的。对于从进化树主枝来的肌动蛋白进行顺序比较的结果表明,肌细胞与非肌细胞的氨基酸顺序约95% 都是相同的。不同种属(牛及兔)的同种肌肉(心肌)的肌动蛋白更是极其相似(仅第97位氨基酸残基不同)。心肌与骨胳肌比较的结果亦只发现骨胳肌第357位的苏氨酸残基被丝氨酸残基取代。这两种可互相取代的氨基酸均含有-OH,可见差别微小。
用稀盐溶液从肌肉中提取的G肌动蛋白常牢固结合着二价阳离子及ATP或ADP。结合比例为1:1:1。肌动蛋白与Ca2+或Mg2+的结合对于稳定其结构及形成肌动蛋白-核苷酸复合物是必需的。Ca2+的结合常数是Mg2+的四倍。然而Mg-G肌动蛋白比Ca-G肌动蛋白更容易聚合。
当溶液的离子强度增加到生理水平时,G肌动蛋白便发生聚合作用,生成F肌动蛋白,同时伴有ATP的水解及蛋白质构象的改变。n[G肌动蛋白·ATP]→[G肌动蛋白·ADP]n+nPi。未结合ATP的肌动蛋白在一定条件下虽也可聚合,但生成的F肌动蛋白不如结合着ADP者稳定。F肌动蛋白的分子量可以超过1 000 000,通过电子显微镜及X射线衍射研究指明F肌动蛋白是互相缠绕的双股螺旋(图4)。沿长轴每隔35.5nm转一圈,出现一次双螺旋转向的交叉。交点之间大约包括13个G肌球蛋白。
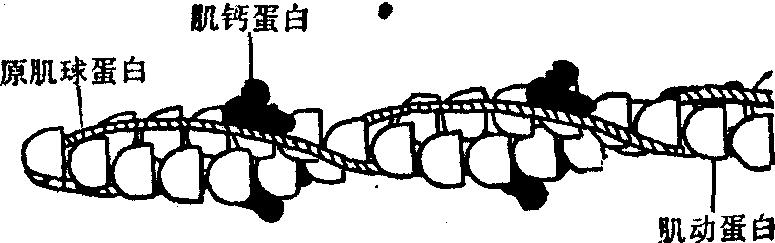
图4 肌动蛋白分子结构
无论G肌动蛋白或F肌动蛋白都有方向性。肌原纤维Z盘两侧细丝的方向相反。前已述及粗丝中线两侧肌球蛋白分子的排列方向相反,因而肌动蛋白与肌球蛋白的相互作用都是在相同的方位下发生的。
前已述及,肌动蛋白可与肌球蛋白结合生成肌动球蛋白从而显著增强ATP酶活性。肌动蛋白对于肌球蛋白·ATP复合物的亲和力低,而对其高能态形式的肌球蛋白 ·ADP·Pi及未结合核苷酸的肌球蛋白具有较高的亲和力。当与肌球蛋白结合的ATP水解成ADP及Pi时,肌动蛋白便与之结合,从而促进能量及ADP和Pi的释放。表现为ATP酶活性增高。此后,另一分子ATP与肌球蛋白结合,肌动蛋白遂与肌球蛋白分离。随后ATP水解为ADP及Pi,肌球蛋白再次处于高能态,肌动蛋白又与之结合。如此每一个轮回提供肌丝每一步滑动所需要的能量。
总之,肌动蛋白是一种多功能的大分子物质。它可与数种蛋白质结合。如与原肌球蛋白及肌钙蛋白结合共同构成细丝,与α辅肌动蛋白结合把细丝连接到Z线。与肌球蛋白结合发生肌丝的相对滑动。还可与某些小分子物质,如Ca2+、Mg2+、ATP等结合。
原肌球蛋白 哺乳类动物肌原纤维中的原肌球蛋白称为原肌球蛋白B,以区别于无脊椎动物的原肌球蛋白A。原肌球蛋白约占肌肉蛋白总量的0.8%,存在于肌原纤维细丝中,占骨胳肌肌原纤维蛋白质总量的10~12%;在平滑肌中含量更高,在心肌中含量较低。原肌球蛋白B的分子量约为65 000~70 000,是由两条呈α螺旋卷曲(占90%以上) 的多肽链互相缠绕而形成的短纤维形蛋白质(直径1.2nm,长40nm)。构成原肌球蛋白的多肽链(亚单位)有α链及β链两种,分子量分别为33 000及37 000。兔骨胳肌原肌球蛋白的α、β链之比约3.5:1。原肌球蛋白分子的结构可能主要是靠两股螺旋之间的疏水相互作用来稳定的。根据是: 在组成原肌球蛋白α链的284个氨基酸残基中疏水氨基酸呈周期性规则分布。而且刚好每3.5个氨基酸残基便出现一个疏水氨基酸,恰与α螺旋每圈包括3.6个氨基酸残基相符合。
原肌球蛋白分子在溶液中极易自相聚合。因而很难准确确定其分子量。在肌原纤维细丝中,原肌球蛋白分子头对尾的线状缔合成串,排列在F肌动蛋白双螺旋的沟槽中(图4)。每分子原肌球蛋白只与F肌动蛋白的一股接触。其长度相当于7个G肌动蛋白的总和。X射线衍射及电镜研究均证明原肌球蛋白的位置随肌肉的生理状态而变动(图5)。肌肉静止时,原肌球蛋白的位置比较浅表,靠近F肌动蛋白沟槽的边缘,遮盖着7个G肌动蛋白分子中与肌球蛋白结合的位点,阻碍肌球蛋白的头(HMM S-1段)与肌动蛋白结合。肌肉兴奋时原肌球蛋白向沟底中心移位,暴露出肌动蛋白分子中结合肌球蛋白的位点,使二者得以相互作用,启动肌丝的相对滑动。此外,在原肌球蛋白分子的每一端可能各有一单股肽段。两股肽链错开排列以致相邻两分子肌球蛋白的这一段单般顺序相互重叠,形成特定的“头、尾”相接。
总之,原肌球蛋白是控制肌肉收缩的一种调节蛋白质。其调控作用是在另一种蛋白质一肌钙蛋白的控制下进行的。在距原肌球蛋白分子N末端三分之二处,靠近第197位氨基酸残基存在着与肌钙蛋白结合的位点。
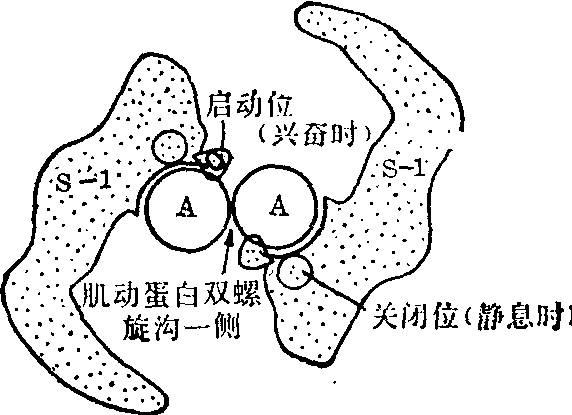
图5 原肌球蛋白的位置
肌钙蛋白 肌钙蛋白又称肌原蛋白或肌宁蛋白,占肌肉蛋白总量的0.2%,存在于细丝中,占肌原纤维蛋白质总量的5%,分子量约为76 000,呈球形。在肌原纤维细丝中每隔约40nm出现一分子肌钙蛋白,此距离相当于原肌球蛋白分子的长度(图4)。换言之,肌钙蛋白与原肌球蛋白按1对1的比例形成复合物与7个G肌动蛋白结合。肌钙蛋白由三个亚单位组成,按功能将其命名为:结合钙亚单位(TN-C)、阻止亚单位(TN-I)及结合原肌球蛋白亚单位 (TN-T)。各亚单位间以非共价键结合。肌钙蛋白的三个亚单位分别发挥不同的作用。TN-T负责肌钙蛋白复合物与原肌球蛋白的稳定连接,并通过位置的改变控制肌动蛋白与肌球蛋白相互作用 ·TN-I与肌动蛋白有很强的结合力,结合紧时,阻碍肌动蛋白与肌球蛋白作用,结合的松紧受Ca2+与TN-C的结合所调节。肌肉兴奋时,肌质网释放Ca2+,以致肌原纤维周围Ca2+的浓度增加100倍(10-7mol/L→10-5mol/L),TN-C的Ca2+结合部位被饱和,从而松解了TN-I与肌动蛋白的结合,同时又使原肌球蛋白向沟底滚动。因而当Ca2+浓度升高时,粗、细丝的相互作用被启动,产生收缩。当Ca2+的浓度降低时(肌质网摄取并贮存Ca2+),Ca2+脱离TN-C,如前所述TN-I遂与肌动蛋白紧密结合,并迫使原肌球蛋白回升到遮盖肌动蛋白分子与肌球蛋白作用的位置,以致肌肉松弛。
α辅肌动蛋白 α辅肌动蛋白的含量虽不到肌原纤维蛋白质总量的1%,但在固定肌动蛋白丝到一定的支持结构上有重要作用。它亦存在于骨胳肌及心肌的Z线、心肌的润盘、平滑肌的密体以及纤维母细胞,肠上皮细胞的桥粒。其分子量为180 000,由二个质量相同的多肽链亚单位构成。易与F肌动蛋白结合形成很牢固的复合物,而且在生理条件下只与F肌动蛋白的一端相结合; 不与G肌动蛋白、原肌球蛋白或原肌球蛋白与肌钙蛋白的复合物结合。当离子强度增加时易自相聚合成大的聚合物。
β辅肌动蛋白 β辅肌动蛋白占肌原纤维蛋白质总量的0.5%,其分子量为70 000,位于细丝的游离末端,可能与控制F肌动蛋白的长度有关,并具有减少F肌动蛋白丝长度的趋势。
结蛋白 结蛋白的分子量为50 000,可聚合成直径10nm的丝,将肌原纤维在Z盘水平横向连接起来,并连到肌膜。其在心肌中的含量特别丰富。
需要指出的是,在各种非肌细胞中都含有肌动蛋白及肌球蛋白,二者的比率一般高于肌细胞。肌动蛋白构成4~6nm的微丝,参与胞质分裂、入胞作用、出胞作用及胞质流动等。非肌细胞的微丝不像肌原纤维细丝那样稳定,常根据细胞的生理活动而组装(聚合)及拆毁(解聚),故在非肌细胞胞质中有一定数量的G肌动蛋白。肌球蛋白丝亦是按需要组装的,一般比横纹肌细胞者短小。在某些非肌细胞中亦发现了原肌球蛋白及肌钙蛋白的TN-C亚单位或其类似物,如钙调蛋白。
- 半导体图层纸是什么意思
- 半导体存储器是什么意思
- 半导体工艺设备是什么意思
- 半导体手册是什么意思
- 半导体技术是什么意思
- 半导体探测器是什么意思
- 半导体收音机是什么意思
- 半导体整流器是什么意思
- 半导体整流器电力机车是什么意思
- 半导体文摘是什么意思
- 半导体材料是什么意思
- 半导体温度表是什么意思
- 半导体激光器是什么意思
- 半导体物理是什么意思
- 半导体物理及器件是什么意思
- 半导体物理学是什么意思
- 半导体研究公司是什么意思
- 半导体研究所是什么意思
- 半导体科学文献索引是什么意思
- 半导体结是什么意思
- 半导体能量转换器件是什么意思
- 半导体薄膜是什么意思
- 半导体设备厂是什么意思
- 半导体词典是什么意思
- 半导体钟是什么意思
- 半导体陶瓷是什么意思
- 半导体集成电路是什么意思
- 半导电玻璃是什么意思
- 半封建是什么意思
- 半封建、半殖民地经济是什么意思
- 半封建半殖民地时期的卫生是什么意思
- 半封建半殖民地的农村经济是什么意思
- 半封建国家是什么意思
- 半封建富农是什么意思
- 半封闭式电动机是什么意思
- 半封闭录取是什么意思
- 半尅是什么意思
- 半尅尅是什么意思
- 半小是什么意思
- 半小时是什么意思
- 半小时广播是什么意思
- 半小时当日新闻是什么意思
- 半小死是什么意思
- 半小鸡是什么意思
- 半尬呆是什么意思
- 半就业是什么意思
- 半就半推是什么意思
- 半尴不尬是什么意思
- 半尴尬是什么意思
- 半尺銅是什么意思
- 半尺铜是什么意思
- 半屏山是什么意思
- 半履带式拖拉机是什么意思
- 半履带式车辆是什么意思
- 半山是什么意思
- 半山亭是什么意思
- 半山人是什么意思
- 半山勿尴尬是什么意思
- 半山勿界是什么意思
- 半山啼鸟烟霞里,一路落花风雨时。是什么意思