细胞的衰老
发生、发育、成熟、衰老和死亡是一切生物的自然发展规律。衰老是细胞死亡的主要途径之一,但不同物种或不同细胞,开始衰老的时间与衰老变化的表现形式,有很大差别。单细胞动物,可以不断分裂增殖,不显衰老现象。多细胞动物的衰老是细胞衰老的结果,但细胞衰老与机体衰老并不相等,其衰老程度也不平行。无论是幼年或老年机体,其中均同时存在着大量幼稚细胞及衰老死亡细胞。
细胞的生理性衰老变化,出现于细胞的衰老阶段,具有内因性(原发性)、进行性(不可逆性)与普遍性等特征。所谓内因性,即指随着年龄增长而出现的自然变化,与疾病及任何外因无关; 进行性是指随着年龄增长而加重的不可逆性变化,外界因素可能延缓或促进其发展,但不能完全阻止或令其消失; 普遍性是指一切细胞在衰老过程中,普遍存在的特征。病理性老化现象,不具有上述特点,并可因治疗而改变或消失。
细胞衰老的特征 细胞衰老首先表现于代谢活动降低(蛋白质、脂肪和糖代谢迟缓,分解代谢超过合成代谢),生理功能减退 (生长速度变慢或停止,细胞分裂指数降低,神经传导速度减慢和痛阈上升等),稳定内外环境能力(适应能力,再生、修复及抗病能力等)下降等方面。在细胞衰老的初期,酶的变化因物种及细胞种类而不同,但琥珀酸脱氢酶及细胞色素氧化酶首先减少,是较为普遍的现象。衰老细胞的形态改变出现较晚,而且是逐渐发生的,其表现形式因细胞种类而不同。基本特征如下:水分减少 人体含水量与年龄、性别及健康状况等有关,可占体重的60—80%,其中2/3于细胞内,1/3位于细胞外。老年机体的含水量比幼年者少,其中细胞内液减少尤甚,可减少到正常的60—70%,因此细胞体积明显缩小。
细胞膜增厚 细胞膜主要由脂类、蛋白质及糖类组成,厚约7.5nm,维持细胞的形态,参与细胞内外的物质交换和接受外界各种信息并作出反应。细胞膜代谢非常活跃,1—2h即可完全更新。细胞膜在细胞老化过程中,占有特别重要的位置,甚至是细胞衰老的起点。通透性及代谢率降低是细胞膜老化的普遍现象,一般均出现较早;但细胞膜的形态改变却出现较晚,而且缺乏特异性。在光镜下一般表现为着色加深与致密化,电镜下可观察到厚薄不匀或断裂等现象。
细胞质嗜碱性减弱 在衰老过程中,细胞代谢率降低,蛋白质合成减慢,粗面内质网逐渐减少,因而细胞质的嗜碱性相应减弱。衰老的神经细胞内尼氏体减少,是较突出的现象。衰老细胞的细胞质,转变为嗜酸性,较为普遍,例如:表皮的角化细胞,结缔组织中的纤维细胞,甲状旁腺的嗜酸性细胞和胸腺小体的退化网状细胞等。
细胞器退化 细胞在衰老过程中,细胞器的形态改变及其发生的时间先后,因物种及细胞种类的不同而各不一样,尚未发现明确的退变规律。但均出现膜结构不清晰、断裂和破碎等现象;最终则呈现细胞器的结构解体与数量减少。
细胞质内含物的改变 衰老细胞的细胞质内,常出现空泡或脂肪滴。除软骨细胞外,细胞质内糖原均明显减少,甚至消失。老年机体的心肌细胞、小脑梨形细胞(Purkinje细胞)、脊髓灰质前柱细胞及肝、肾、肾上腺等器官的实质细胞内,常见聚积棕褐色的脂褐质。脂褐质随年龄增加而变多,在不同的细胞内具有一定分布规律,被视为细胞衰老的形态学标志。
细胞核的变化 在细胞衰老过程中,细胞核功能的衰退发生较早,突出表现于脱氧核糖核酸复制及核糖核酸转录功能降低或失常。细胞核的形态变化,通常呈现体积缩小、着色加深、形状不规则、核基质透明度降低和核仁缩小等现象,最终则出现核碎裂或溶解,电镜下常见核被膜内陷、结构不清晰及断裂等现象。
核质比缩小 衰老细胞的体积随着细胞内液的减少而缩小,其中以核的缩小更为明显,因此细胞质所占比例相对增加,核质比例有所缩小。
非整倍体细胞增多 随着机体的衰老,染色体的数目与形态,均可发生异常。肝细胞中常出现超二倍体细胞及非整倍体细胞,这些细胞代谢活动旺盛,镜下可见核及核仁增大。核的畸变率可作机体衰老的标志之一,例如青年人白细胞中,非整倍体细胞仅占1%左右,老年人可达10%;小白鼠从两个月到20个月,其肝细胞的染色体畸变率可增加三倍以上。
神经细胞退变 人从成年(30岁)以后,神经细胞即不断退变减少,一般认为80岁老人脑内的神经细胞数仅有青年人的60%左右。神经细胞衰老退化的形态学表现,除脂褐素逐渐增多外,尚常见神经原纤维退变消失、神经纤维粗细不匀、突触减少、大脑锥体细胞侧棘减少等现象。
局部增生与代偿性肥大 衰老机体的某些细胞或器官,可能发生异常增生或代偿性肥大。例如:心脏常因克服外周较大的血流阻力而出现肥大; 肺脏因异物沉积及纤维化而变重;某些上皮细胞,在老年期可过度增殖而转化为癌细胞。
细胞问质衰老的基本形态改变,主要表现于: 基质减少,纤维成分增多;胶原纤维束变粗,不易溶解成分增多;弹性纤维失去弹性; 代谢不活泼的脂肪增加等。某些器官的细胞间质内,化学成分改变比较明显,例如血管壁内胆固醇沉积,软骨基质钙化和骨质脱钙等。
细胞衰老学说 由于引起衰老的原因很复杂,在实际研究工作中,对于细胞的衰老变化与病理变化往往难以分辨;甚至对于细胞的某些改变,究竟是衰老的原因抑或结果,是原发的还是继发的也不易判定;更兼以人们的认识角度不同,所以关于衰老的本质,至今仍众说纷纭。从现有研究结果来看,可以认为细胞衰老依次由遗传素质、细胞随机退变与内外环境条件所决定,其中遗传素质是根本决定因素,细胞随机退变是重要促进因素,内外环境条件是协调影响因素。多细胞动物的细胞、组织和器官之间,存在着复杂的相互依存、制约、协调与反馈关系,因此神经系统、内分泌系统和免疫系统的衰退,对机体的衰老起着重要作用。以下是几个有代表性的细胞衰老学说。
遗传素质决定学说 寿命与遗传有密切关系,这是人们很早就注意到的事实,因此关于这方面的衰老学说,提出的最早也最多。该类学说的基本论点为动物寿命的长短是在进化过程中,通过自然选择逐渐形成并因遗传物质逐代遗传的。诸如动物的“生长—成熟—衰老—死亡”、昆虫的变化过程(卵—幼虫—蛹—成虫)、人胸腺的定期退化等都是按照由基因决定的次序,像时钟一样逐步展现的。支持遗传素质决定寿命的实例很多。在自然界,不同物种或不同种属的动物(植物亦如此)各有一定的寿命。例如人的最高寿命约为120—150岁,鸡、鸽约30年,犬、兔约20年,大、小白鼠约2—3年。有文字记载以来,随着社会条件和生活条件的改进,人的平均寿命不断提高,例如中国人的平均寿命1957年为57岁,1980年为70岁,但最高年龄则变化不大。
大量统计资料表明,人群的某些家族中,长寿者较多,双胞胎的两个个体的寿命常彼此近似,其中直孪生(单卵双胞胎)的寿命差距更小。实验动物中,此类现象也很常见。
体外培养细胞的寿命,与供体寿命也有密切关系。例如:人的成纤维细胞,在良好培养条件下,一般可分裂50代左右;鸡的成纤维细胞约可分裂25代,而小白鼠的仅可分裂12代左右。若将同种幼年与老年动物的同种细胞,分别以同样条件培养,则幼年细胞继续分裂的代数多于老年细胞。若将培养的细胞,迅速冷冻保存于-196℃条件下,数年之后再将其复苏并继续进行培养时,其冷冻前后所分裂的总代数,与未经冷冻处理基本相同,也不因超低温保存时间的久暂而改变。
关于基因如何具体控制寿命,则有许多不同的见解,因而有不同的学说,如修饰基因学说、重复基因枯竭学说、DNA修复能力下降学说等。此外,尚有自身免疫学说、内分泌失调学说等,都属于衰老的遗传学说范畴。但这些方面的功能衰退,应视为某些细胞衰老的结果。
自由基损伤学说 自由基是在外层轨道上具有不成对价电子的原子或原子团,如“H·”、“·CH3”…等。
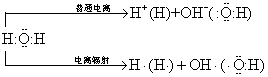
在化学反应过程中,当化合物分子中的共价键断裂时,其共用电子对若为一方所独有,即形成离子;若共用电子对分别属于两个原子或原子团,即形成自由基。例如:水在通常电离时,形成离子“H+”及“OH-”; 但在电离辐射条件下,则可形成自由基“H·”、“OH·”。
在一般条件下,自由基不能稳定存在,瞬间即逝,其平均寿命仅有10-3秒左右。
生物化学反应过程中,经常产生大量的自由基,其主要来源一般是氢氧根自由基(HO·)、氢自由基(H·)及超氧自由基(·O-2)。普通氧(O2)的氧化能力很弱,但自由基氧化能力很强,极容易自行结合成为稳定的分子,或与其他物质发生反应产生新自由基,因此自由基反应一般是链锁反应。
机体内的自由基,是生物化学代谢过程的中间产物。例如生物氧化、生物催化、电子传递、能量传递等过程,无论是在生理或病理情况下,均可产生自由基。机体内的抗氧化活性物质(如抗氧化剂、自由基捕获剂、抗氧化物酶),可捕获化学反应中产生的各种自由基,使其失去活性。在生理情况下,自由基的过氧化作用与抗氧化活性物质的作用,基本维持平衡。但随着年龄的增长,抗氧化活性物质逐渐减少,自由基水平则逐渐增高。
自由基损伤学说认为,机体随着年龄增长而增多的自由基是细胞衰老的根源。例如: 自由基可氧化酶中的巯基(—SH),导致多种酶失活。自由基与脂质结合,形成过氧化脂质,可导致生物膜退变。细胞膜结构的退变,可影响其通透性与选择性,干扰细胞内外的物质交换与细胞代谢。同时也破坏了其对信息的接受传递与应答的正常功能,从而导致细胞衰老。溶酶体膜若发生退变断裂,其中储存的大量酸性水解酶即可释放出来直接溶解细胞。自由基引起的过氧化脂质分解时产生的醛基(—CHO),可与蛋白质、磷脂等大分子发生交联结合(交联键),使其聚合成为不溶性的棕黄色颗粒—脂褐质。脂褐质本身不直接损害细胞,但积累过多时可由于占据细胞的有效空间而影响细胞的代谢活动。脂褐质的主要成分是脂类(主要为磷脂)、蛋白质、抗水解有色物质,并可含有锌、铜、钙等微量元素。脂褐质的存在比较普遍,不仅见于高等动物,而且见于低等动物、单细胞动物和体外培养细胞。各种细胞中的脂褐质,虽然在数量、形态、分布、化学成分、出现规律等方面,可能有某些差别,但它们随年龄增长而增多,有自发荧光,难以溶于水、酸、碱及有机溶剂,在组织标本制备过程中也不消失等特点是一致的,因此一般将脂褐质视为细胞衰老的主要形态标志之一。DNA两股链之间的交联结合,使DNA结构变形,不能进行正常复制,从而可导致蛋白质(包括酶)合成异常,细胞退变、衰老和死亡。蛋白质分子之间的交联结合过多,可形成不能被分解的大分子聚集物。此种聚集物若在细胞内,可影响细胞的正常代谢活动;若发生于细胞间质(如胶原纤维),则限制纤维与纤维之间的正常活动,干扰细胞与间质之间的激素、营养物质和代谢产物的通透与交换,从而导致细胞代谢率降低,进而引起衰老与死亡。
自由基促进衰老学说,在生理、病理及医疗实践中,均得到支持。例如:膜稳定剂(如氢化可的松)可使体外培养细胞的寿命延长40%;抗氧化剂(如维生素C、E,半胱氨酸和谷胱甘肽)可延长小白鼠及体外培养细胞的寿命,推迟并减少脂褐素的出现与堆积。
与自由基有关或近似的细胞衰老学说很多,如生物膜损伤学说、溶酶体膜损伤学说、细胞膜通透性改变学说、过氧化脂质增多学说、交联学说、氧化还原学说等。
蛋白质合成差错学说 蛋白质是一切生命的物质基础,约占人体干重的45%。不同物种有不同的蛋白质,每种蛋白质均有其特有的分子结构与功能。人体的蛋白质不下10万种,均处于不断更新过程中。这种新陈代谢一旦停止,生命即随之终结,蛋白质也就分解消失了。
蛋白质合成差错说认为,从DNA复制到蛋白质合成的过程中,各阶段内均有酶及其他成分和条件参与,任何阶段都有可能发生某种差错。当这些差错较少时,不致引起任何异常后果,甚至可能自行修复。但当这些差错积累过多时,就可能产生异常的蛋白质,影响细胞的代谢功能与结构,导致细胞衰老。一般认为,DNA自我复制阶段,产生差错的机率较少;由DNA转录形成mRNA阶段,发生误差的机率有所增多;由RNA到蛋白质形成阶段,出现误差的机率会更多些。关于蛋白质合成发生误差的根本原因,可能来自亲代的遗传信息,也可能来自电离辐射、紫外线、烷化剂或某些抗生素(如更生霉素、自力霉素)等的干扰。
环境因素影响学说 环境因素影响细胞衰老学说认为,机体寿命的长短,虽然主要由遗传因素决定,但内、外环境条件及代谢特点也与寿命密切相关; 尤其是不再分裂的终末细胞,其衰老速度显然为物质代谢所左右。例如,中国人的平均寿命,1949年以前不到40岁,1957年为57岁,1980年为男性69岁、女性70岁,这显然与社会安定与进步有关。
大量事实表明,环境温度与衰老也有关系。例如埃塞俄比亚人的平均寿命仅40多岁,而冰岛、瑞士、日本人的平均寿命则接近80岁。中国的“老寿星”以新疆为最多。实验证明,果蝇在26℃条件下,一般可存活50天左右,在18℃条件下可活到100天,在10℃条件下可能活到200天。即环境温度每降低8℃,其寿命可延长一倍。
机体代谢率与寿命长短有一定关系,小动物一般代谢率较高,成熟比较快,寿命较短。例如: 小白鼠的寿命约2—3年,而大象则可活200年。以大小相似的同类动物——小白鼠与蝙蝠相比,蝙蝠的代谢率较低(活动时间较短,有冬眠期),其寿命比小白鼠可长3—4倍。此外以同种系小白鼠作实验,假如在保证全营养原则下降低热量或于饲料中加入半胱氨酸、溴化钠等,均可明显延长其寿命;但若加入较多的脂肪或胆固醇,则可缩短其寿命。在细胞培养工作中可以见到,当培养基中代谢废物积存过多,营养成分缺乏时,细胞增殖减慢甚至停止; 但在更换新鲜培养液后,细胞又可以恢复正常生活能力。
与该学说有关或近似的衰老学说很多,如代谢产物蓄积说、自家中毒说、体细胞突变说等。
总之,细胞衰老是复杂的生物学现象,应该是以遗传素质为主的多种因素综合作用的结果。现有的细胞衰老学说,尚不能解释细胞衰老的本质,有的尚缺乏直接证据,有些实验结果尚不一致或不具有普遍性。
- 脞是什么意思
- 脞录是什么意思
- 脞水是什么意思
- 脞言是什么意思
- 脞说是什么意思
- 脞身是什么意思
- 脟是什么意思
- 脟扎下是什么意思
- 脟条肉是什么意思
- 脠是什么意思
- 脠子汤是什么意思
- 脡是什么意思
- 脡祭是什么意思
- 脡脡然是什么意思
- 脢是什么意思
- 脢条是什么意思
- 脢条肉是什么意思
- 脢肉是什么意思
- 脣是什么意思
- 脣吻是什么意思
- 脣呡是什么意思
- 脣脂是什么意思
- 脤是什么意思
- 脤介时候是什么意思
- 脤膰是什么意思
- 脥是什么意思
- 脦是什么意思
- 脦俚寋是什么意思
- 脦肋是什么意思
- 脦肋兵是什么意思
- 脦脦肋肋是什么意思
- 脧是什么意思
- 脧仔是什么意思
- 脧削是什么意思
- 脧取脧刻是什么意思
- 脧子是什么意思
- 脧盗是什么意思
- 脨是什么意思
- 脩是什么意思
- 脩习是什么意思
- 脩人是什么意思
- 脩况是什么意思
- 脩刺是什么意思
- 脩名是什么意思
- 脩嫮是什么意思
- 脩平是什么意思
- 脩敬是什么意思
- 脩眉是什么意思
- 脩短是什么意思
- 脩禊是什么意思
- 脩竹三间屋,清泉二顷田。是什么意思
- 脩縮是什么意思
- 脩缮是什么意思
- 脩羊是什么意思
- 脩美是什么意思
- 脩股民是什么意思
- 脩脃是什么意思
- 脩脡是什么意思
- 脩脩是什么意思
- 脩脯是什么意思