纤维状蛋白质
纤维状蛋白质
纤维状蛋白质多为动物结缔组织的重要蛋白质,如胶原蛋白、角蛋白、纤维蛋白及肌纤蛋白等。
胶原蛋白 为三股螺旋结构,胶原的基本结构单位原胶原蛋白具有三股螺旋的空间结构,即由三条左手螺旋的单股肽链相互盘绕成为一个右手超螺旋的纤维状蛋白质。每条肽链大约由1000个左右氨基酸残基组成,它不同于一般蛋白结构中典型的α螺旋,而是稍有伸展,每个氨基酸残基使螺旋平均上升0.29nm。因此,原胶原蛋白分子一般长达300nm左右,直径为0.15nm。
根据原胶原中α肽链结构组成的差别,脊椎动物体内的原胶原有四个类型。其中Ⅰ型原胶原由两种α肽链组成,其它三型皆由三条相同的α肽链组成。它们各有不同的分布(表)。
原胶原蛋白分子的三股螺旋结构与其肽链氨基酸的组成特点有关。上述各种α肽链中都有近1/3的氨基酸残基是甘氨酸。在氨基酸的排列顺序中,每隔两个其他氨基酸残基就有一个甘氨酸残基。整个结构可用 (甘-X-Y)。来表示,式中X、Y分别代表其它氨基酸。此种有规则的结构是使三条α链结合成三股螺旋的重要条件。例如,原胶原α1 (I)肽链由1052个氨基酸残基组成,其氨基末端16个氨基酸残基及羧基末端25个氨基酸残基无上述典型的甘-X-Y结构,不能形成三股螺旋,故成为伸展部分(或称尾肽)。原胶原中还含有其他蛋白质中很少见的羟脯氨酸及羟赖氨酸残基,脯氨酸及赖氨酸残基的含量也较多,这些氨基酸与形成α肽链之间或原胶原分子之间的共价交联有关,是胶原纤维结构稳定的主要化学基础。
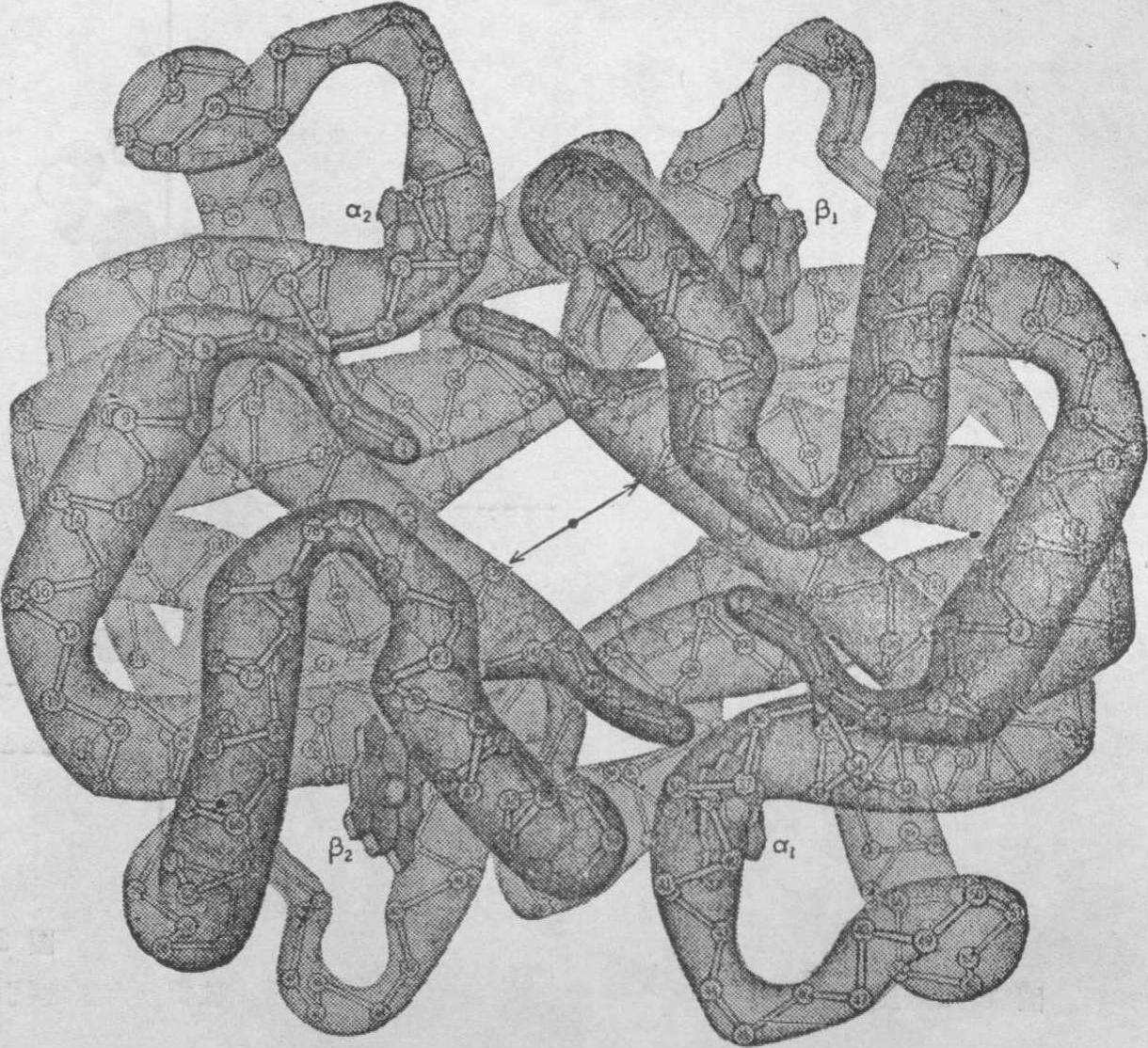
图4 氧合血红蛋白四级结构示意图
(引自Prank B Armstrong:Biochemistry p.110,1983)
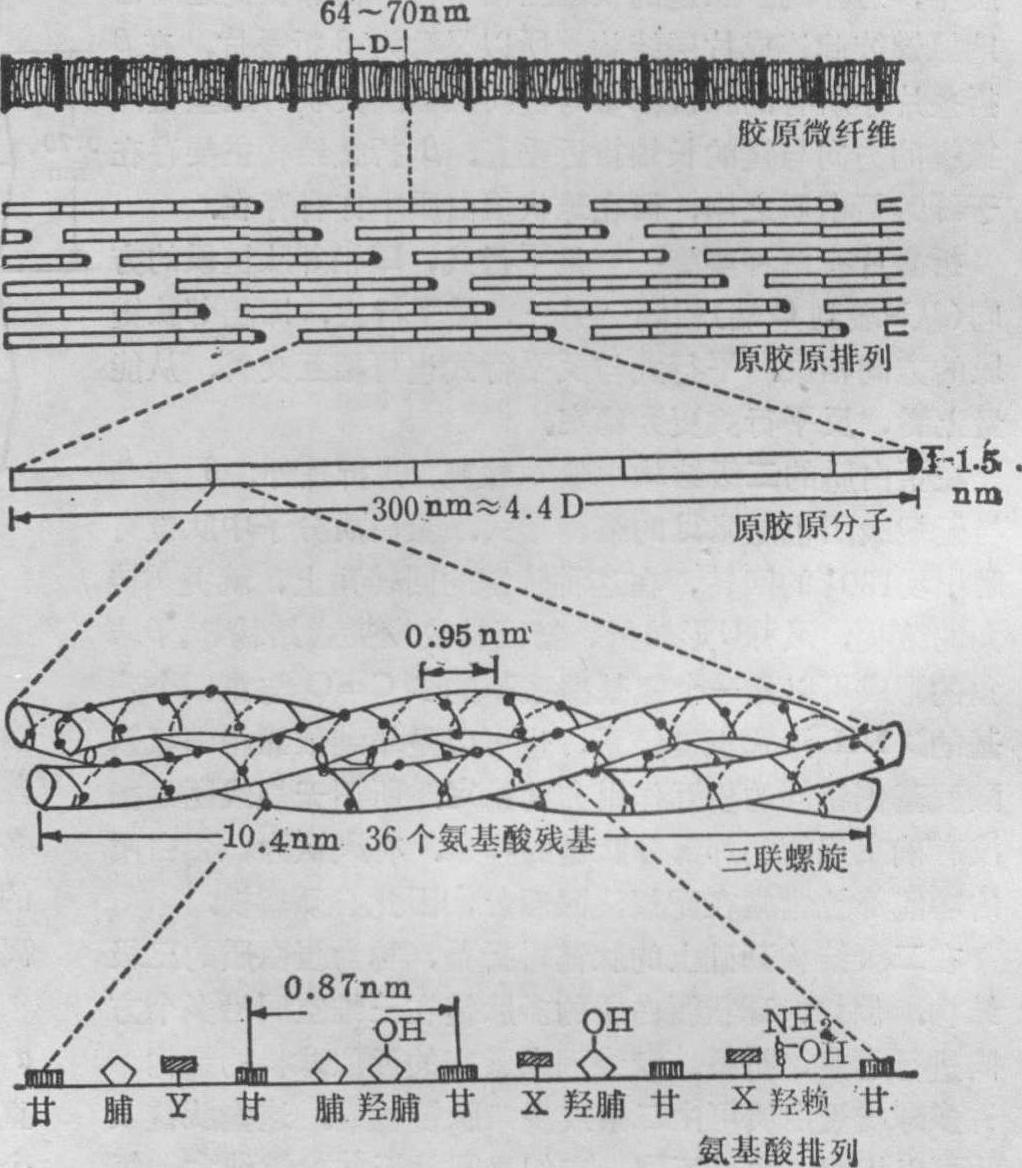
原胶原蛋白的三股螺旋结构
各型原胶原的组成与分布
| 分型 | 肽链组成 | 主要氨基酸残基的相对含 量/1000残基 | 体内分布 | ||||
| 甘 | 脯 | 羟脯 | 赖 | 羟赖 | |||
| Ⅰ | [α1(Ⅰ)]2α2 | 330 | 129 | 96 | 30 | 4 | 真皮、肌键、骨齿等 |
| Ⅱ | [αⅠ(Ⅱ)]3 | 320 | 108 | 100 | 13 | 21 | 软 骨 |
| Ⅲ | [α1(Ⅲ)]3 | 360 | 109 | 112 | 35 | 5 | 婴儿皮肤、心瓣膜、 大血管 胃肠道 |
| Ⅳ | [α1(Ⅳ)]3 | 325 | 60 | 163 | 5 | 42 | 基底膜、水晶体 |
角蛋白 为毛发、爪甲中的重要成分,其分子主要由含有α螺旋的多肽链所组成,几条多肽链之间有较多的二硫键维系着,这种三股交缠的α螺旋即形成原纤维,其直径约为2nm,毛发以原纤维为基本单位。
其它纤维状蛋白质还有弹性蛋白和回弹蛋白等,前者存在于动物结缔组织的细胞间隙,特别在动脉壁及支气管等处较为丰富,这与该组织的弹力有关,后者为蝗虫及蚱蜢胸骨上的一种透明弹性蛋白,它与上述弹力蛋白的结构不同,含有由交联酪氨酸残基而成的三酪氨酸结构,是一种理想的蛋白橡皮。
☚ 蛋白质的空间结构 球状蛋白质 ☛
- md200706050_008001001005是什么意思
- md200706050_008001001006是什么意思
- md200706050_008001002是什么意思
- md200706050_008001002001是什么意思
- md200706050_008001002002是什么意思
- md200706050_008001002003是什么意思
- md200706050_008001002004是什么意思
- md200706050_008001002005是什么意思
- md200706050_008001002006是什么意思
- md200706050_008001002007是什么意思
- md200706050_008001002008是什么意思
- md200706050_008001002009是什么意思
- md200706050_008001002010是什么意思
- md200706050_008001002011是什么意思
- md200706050_008001002012是什么意思
- md200706050_008001002013是什么意思
- md200706050_008001002014是什么意思
- md200706050_008001002015是什么意思
- md200706050_008001002016是什么意思
- md200706050_008001002017是什么意思
- md200706050_008002是什么意思
- md200706050_008002001是什么意思
- md200706050_008002001001是什么意思
- md200706050_008002002是什么意思
- md200706050_008002002001是什么意思
- md200706050_008002002002是什么意思
- md200706050_008002002003是什么意思
- md200706050_008002002004是什么意思
- md200706050_008002002005是什么意思
- md200706050_008002002006是什么意思
- md200706050_008002002007是什么意思
- md200706050_008002002008是什么意思
- md200706050_008002002009是什么意思
- md200706050_008002002010是什么意思
- md200706050_008002003是什么意思
- md200706050_008002003001是什么意思
- md200706050_008002003002是什么意思
- md200706050_008002003003是什么意思
- md200706050_008002003004是什么意思
- md200706050_008002003005是什么意思
- md200706050_008002003006是什么意思
- md200706050_008002003007是什么意思
- md200706050_008002004是什么意思
- md200706050_008002004001是什么意思
- md200706050_008002004002是什么意思
- md200706050_008002004003是什么意思
- md200706050_008002004004是什么意思
- md200706050_008002004005是什么意思
- md200706050_008002004006是什么意思
- md200706050_008002005是什么意思
- md200706050_008002006是什么意思
- md200706050_008002006001是什么意思
- md200706050_008002006002是什么意思
- md200706050_008002006003是什么意思
- md200706050_008002007是什么意思
- md200706050_008002007001是什么意思
- md200706050_008002007002是什么意思
- md200706050_008002007003是什么意思
- md200706050_008002007004是什么意思
- md200706050_008002007005是什么意思