硅烷
硅烷guiwan
一系列硅的氢化物的总称,结构与饱和碳氢化合物类似。目前已制得的有SiH4,SigH6,Si3H8,Si4H10,Si5H12,Si6H14,即一硅烷到六硅烷,可用通式SinH2n+2 (7>n≥1) 表示。前4种硅烷的物理性质见下表。
四种硅烷的物理性质
| 分子式 | SiH4 | Si2H6 | Si3H8 | Si4H10 |
| 状 态 熔点/℃ 沸点/℃ 液态相对 密 度 | 无色气体 -185 -111.8 0.68 | 无色气体 -132.5 -14.5 0.686 | 无色液体 -117.4 52.9 0.725 | 无色液体 -84.3 107.4 0.79 |
| 溶解性 | 不溶于冷 水、 醇、 醚等, 在 氢氧化钾 中分解 | 微溶于冷 水 并 分 解, 溶于 醇、 苯、 二硫化碳 | 在水和四 氯化碳中 分解 | 在水中分 解 |
硅烷的化学性质比烷烃活泼。所有硅烷的热稳定性都很差,分子量大的稳定性更差。SiH4和Si2H6在400℃时开始分解为硅和氢气,Si4H10在室温下已明显分解,Si6H14分解速率更快。硅烷在空气中能自燃,放出大量热,生成二氧化硅和水。在室温下,硅烷与卤素的反应以爆炸方式激烈进行,得到卤硅烷。在催化剂存在下,能与卤化氢作用生成卤化物,如:
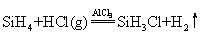
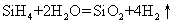
SiH4+2KMnO4=2MnO2↓+K2SiO3+H2↑+H2O
此反应可用于检验硅烷。硅烷在催化剂存在下,还能与氯仿发生氢和氯的对换作用。硅烷可用硫酸或磷酸水解硅化镁来制备,产物为硅烷混合物; 现在常利用氢化铝锂与卤化硅在乙醚中反应来制备:
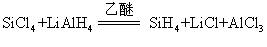
☚ 硅 二氧化硅 ☛
硅烷
又称硅氢化合物。只含硅和氢两种元素的化合物,有机硅中组成最简单的类型。组成、结构和物理性质类似烷烃,化学性质比烷烃活泼,不稳定。硅烷只有含硅原子数不很多的同系物。
硅烷
silane
- manila是什么意思
- manila abaca是什么意思
- manila bay是什么意思
- manila hemp(或abaca)是什么意思
- manilius capitolinus,marcus是什么意思
- manille 马尼拉是什么意思
- mani madhava chakyar是什么意思
- mani mahko是什么意思
- mani ma-ni是什么意思
- mani manjusa是什么意思
- manimantha是什么意思
- maniman ⅰ是什么意思
- maniman ⅱ是什么意思
- maniman ⅲ是什么意思
- maniman ⅳ是什么意思
- maniman ⅴ是什么意思
- maniman ⅵ是什么意思
- manimatipuri (manimatpattanam)是什么意思
- manimaya是什么意思
- manimekalai是什么意思
- maninaga ⅰ是什么意思
- maninaga ⅱ是什么意思
- maning是什么意思
- maning din是什么意思
- maning moining是什么意思
- mani ni是什么意思
- manini是什么意思
- manin,daniele是什么意思
- manioc是什么意思
- maniparvala是什么意思
- maniparvata是什么意思
- mani-pas是什么意思
- manipravalam是什么意思
- manipulate是什么意思
- manipur是什么意思
- manipura (manipur)是什么意思
- manipuri dance是什么意思
- manipur pradesh是什么意思
- manipuspaka是什么意思
- mani ratnam是什么意思
- manisa是什么意思
- mani sai是什么意思
- mani sengbreng是什么意思
- maniskandha是什么意思
- mani sum是什么意思
- manit是什么意思
- mani ta是什么意思
- manit dai是什么意思
- manit dong是什么意思
- manit ga是什么意思
- manit hka是什么意思
- manit lata是什么意思
- manit ni是什么意思
- manitoba是什么意思
- manitoba 马尼托巴是什么意思
- manitoba,lake是什么意思
- manitou是什么意思
- manitoulin islands是什么意思
- manit ta是什么意思
- maniu,iuliu是什么意思