电负性dianfuxing
1932年L.鲍林最先提出电负性的概念,“电负性是元素的原子在分子中吸引电子的能力”。电负性不仅可以用来判断元素的金属性和非金属性,还可以合理地说明键长、键能、键偶极矩、键型过渡及其他一系列结构与性能规律,是化学上应用最广的基本概念之一。鲍林根据热化学的数据和分子的键能,指定氟的电负性为4.0 (后又精确为3.98),并求出了其他元素的相对电负性。在鲍林电负性标度的基础上,后来又有许多人作了更精确的计算。
1934年R.A.密立根进一步研究电负性意义,考虑到仅用电离势I和电子亲合势Y一方的大小来衡量元素的金属性和非金属性,有一定的片面性。特别是在原子相互化合时,原子是得电子还是失电子,必须把该原子失电子和得电子的难易统一起来考虑。即,在化合物分子中某原子吸引电子的能力或本领是与其元素的I和Y都有关。一个原子的 (I+Y)之值反映了某元素的一项重要属性,是原子在分子中吸引成键电子的能力或本领。他提出用I和Y结合来求电负性的标度。即
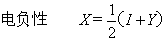
1957年阿莱-罗周 (Allred-Rochow),提出了建立在核与成键原子的电子间静电作用基础上的电负性标度。根据库仑定律,核对该电子的引力F是

Z*e是作用于外层一个电子上的有效核电荷 (可由斯莱脱规则求出); r是原子的共价半径; e是一个电子电荷。因而由上述公式得到电负性的值也是绝对值。它和鲍林的相对电负性值是不同的。
但是,许多元素的电负性X值是按下式计算的:
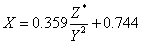
得到的X值与鲍林的电负性数据很相近,式中两个常数的引入是为了使计算出的电负性值与鲍林的值吻合。
3套电负性数据,同一元素的数值不完全相同,但它们皆反映了元素的原子在化合物中吸引电子的能力或本领,有一定的内在联系,密立根电负性值和阿莱-罗周电负性值都与鲍林电负性值有线性关系。3套数据能较好地吻合,只在某些元素上略有差异。
但是分子中原子吸引电子的能力还与所形成化学键的类型、不同氧化态等因素有关。如,Fe2+,Fe3+的电负性值分别为1.7与1.8; Sn2+和Sn4+分别为1.8与2.0。加上目前对分子中电子的分布尚不能准确测定,要得出精确的电负性是困难的,目前,有关电负性的定义和标度方法有多种,各数值也不一样,正在发展之中。
电负性
元素原子在分子中吸引电子的能力。吸引电子能力愈大,电负性就愈大。美国化学家鲍林于1932年首先提出,经许多人的发展形成了多种电负性。已被看作是原子的一个极为重要的特征,应用于理论化学和应用化学领域的各个分支。
电负性
原子吸引在化学键中与另一原子共用的电子偶的能力。化学元素电负性常用的度量标准是L·鲍林Linus Pauling1901—于1932年得出的电负性标度,标度根据元素的电负性从高至低排成表。氟最高,铯最低。这一标度是把各种不同原子组合间的化学键所带的能量进行比较得出的。另一种标度是通过测量原子的电离电势和电子亲合势而得,与鲍林标度的值很近。电负性差别大的元素趋向于结成离子化合物。差别较小的元素则组成极性共价化合物,但仍表现一定程度的电离。电负性近于相等的元素则结合成非极性化合物,只显示弱的电荷分离。
- 论新闻报道是什么意思
- 论新阶段是什么意思
- 论方是什么意思
- 论无产阶级专政的小册子的提纲是什么意思
- 论无产阶级在这次革命中的任务是什么意思
- 论无产阶级艺术是什么意思
- 论日耳曼人的古代历史是什么意思
- 论旧忽余悲。是什么意思
- 论旨是什么意思
- 论旨不明是什么意思
- 论时是什么意思
- 论明代朱谏的对李白和杜甫的观点看法是什么意思
- 论昏是什么意思
- 论智是什么意思
- 论曰:人年五十以去, 皆大便不利, 或常苦下痢, 有斯二疾, 常须预防: 若秘涩, 则宜数食葵菜等冷滑之物; 如其下痢, 宜与姜韭温热之菜, 所以老人于四进之中, 常宜温食, 不得轻之。是什么意思
- 论曰:非但老人须知服食将息节度,极须知调身按摩,摇动肢节,导引行气。是什么意思
- 论曲绝句三十二首是什么意思
- 论曲绝句十四首是什么意思
- 论有限单群是什么意思
- 论朱竹坨氏言京东水之地误是什么意思
- 论朴素的诗和感伤的诗是什么意思
- 论机智与幽默的区别 [美国]布鲁克斯是什么意思
- 论杀是什么意思
- 论杂文是什么意思
- 论权威是什么意思
- 论李杜的清丽观是什么意思
- 论李白文化人格的美学境界是什么意思
- 论李白诗中的太阳意象是什么意思
- 论材是什么意思
- 论材何必多,适用即能神。是什么意思
- 论杜康是什么意思
- 论来敏是什么意思
- 论柄是什么意思
- 论核是什么意思
- 论梁元帝读书是什么意思
- 论次是什么意思
- 论欧洲联邦口号是什么意思
- 论歌是什么意思
- 论武侠小说是什么意思
- 论死是什么意思
- 论死亡的形而上学 [德国]齐美尔是什么意思
- 论段是什么意思
- 论比是什么意思
- 论毛泽东同志关于刑法学的光辉思想及重要贡献是什么意思
- 论民主革命的文艺运动是什么意思
- 论民园是什么意思
- 论民族自决权是什么意思
- 论民本是什么意思
- 论民间反语是什么意思
- 论气·气声是什么意思
- 论气节是什么意思
- 论求是什么意思
- 论求婚是什么意思
- 论求知 [英国]培根是什么意思
- 论汤显祖及其他是什么意思
- 论治道人才疏是什么意思
- 论法是什么意思
- 论法的精神是什么意思
- 论波兰是什么意思
- 论浪漫派是什么意思