电解产物的计算
电解产物的计算dianjie chanwu de jisuan
根据电极反应式或电解方程式进行计算。
例1 用铂作电极,向1000 g浓度为10%硫酸溶液中通电,当溶液浓度变为12%时停止通电。
❶写出电极反应式和总的电解方程式。
❷两极产生的气体各有多少升(标准状况)?

(阴) (阳)
❷设标准状况下,产生H2为xL,O2为yL
原硫酸质量=1000×10%=100(g)
水的质量=1000-100=900(g)
当浓度变为12%时:

答 标准状况下,产生氢气208L,氧气104L。
例2 电解AgNO3溶液,当阴极析出10.8g银时,通过多少库仑的电量?已知一个电子所带的电量为1.602×10-19C。
解
❶求电子的物质的量(设为xmol):
阴极反应 Ag+ +e =Ag↓
1mol 108g
x 10.8g
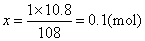
❷所需电量=0.1×6.02×1023×1.602×10-19
=9644 (C)
答 通过9644C的电量。
例3 某硝酸盐晶体分子式为M(NO3)x·nH2O,分子量为242,将6.05g该晶体溶于水,配成500 mL溶液进行电解(用铂作电极),当有0.05 mol电子转移后,溶液中金属离子全部析出,经干燥称重,一个电极质量增加了1.6 g,求:
❶金属M的原子量及x、n值;
❷ 电解后溶液的pH值(电解过程中电解液体积减少忽略不计)。
解
❶Mx+的物质的量=
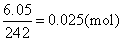
NO-3的物质的量=0.025x(mol)
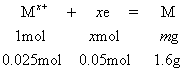
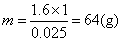
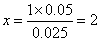 该Mx+为Cu2+
该Mx+为Cu2+
64+62×2+18n=242 n=3
❷设硝酸物质的量为ymol
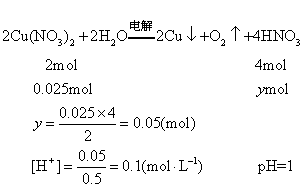
答 硝酸盐晶体分子式为Cu(NO3)2·3H2O,电解后溶液pH值为1。
☚ 键能的计算 工业化学 ☛
- 䲭鴟是什么意思
- 䲭鸱是什么意思
- 䲮是什么意思
- 䲰是什么意思
- 䲰日是什么意思
- 䲱是什么意思
- 䲲是什么意思
- 䲳是什么意思
- 䲸是什么意思
- 䲹是什么意思
- 䲻是什么意思
- 䲻鳥是什么意思
- 䲻鸟是什么意思
- 䲼是什么意思
- 䲽是什么意思
- 䲽鳥是什么意思
- 䲽鸟是什么意思
- 䲾妇是什么意思
- 䲾婦是什么意思
- 䳀是什么意思
- 䳂是什么意思
- 䳃是什么意思
- 䳄是什么意思
- 䳅是什么意思
- 䳅鵌是什么意思
- 䳆是什么意思
- 䳇是什么意思
- 䳈是什么意思
- 䳉是什么意思
- 䳋是什么意思
- 䳍是什么意思
- 䳎是什么意思
- 䳏是什么意思
- 䳐是什么意思
- 䳐鳥是什么意思
- 䳐鸟是什么意思
- 䳑是什么意思
- 䳒是什么意思
- 䳓是什么意思
- 䳔是什么意思
- 䳕是什么意思
- 䳕鳩是什么意思
- 䳕鸠是什么意思
- 䳖是什么意思
- 䳘是什么意思
- 䳙是什么意思
- 䳚是什么意思
- 䳚旦是什么意思
- 䳜是什么意思
- 䳝是什么意思
- 䳟是什么意思
- 䳠是什么意思
- 䳢是什么意思
- 䳢老是什么意思
- 䳢鶨是什么意思
- 䳤是什么意思
- 䳤𩿧是什么意思
- 䳥是什么意思
- 䳧是什么意思
- 䳨是什么意思