电离度的计算
电离度的计算dianlidu de jisuan
弱电解质在水中只部分电离,电离达平衡时,已电离的溶质分子数与溶质分子总数之比称电离度,用α表示。

例1 0.02mol·L-1醋酸溶液的电离度为2.96%,求该溶液中氢离子浓度。
解 醋酸为一元酸
[H+]=α·c=0.02×2.96%
=5.92×10-4(mol·L)-1
答 溶液中的氢离子浓度为5.92×10-4mol·L-1。
例2 今有2mol·L-1氨水1500mL,NH3·H2O的电离度为1.3%,求已电离和未电离的NH3·H2O的物质的量。
解 1500mL溶液溶质的物质的量nB=CB·V=2×1.5=3(mol)
已电离的NH3·H2O物质的量为3×1.3%=0.039(mol)
未电离的NH3·H2O物质的量为3-0.039=2.961(mol)
答 已电离的 NH3· H2O的物质的量为0.039mol,未电离的 NH3· H2O的物质的量为2.961mol。
例3 0.1mol·L-1氢氟酸溶液2L,其中没有电离的氢氟酸分子为0.186 mol,求该浓度下氢氟酸溶液的电离度。
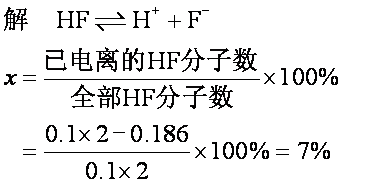
答 0.1mol·L-1 HF溶液的电离度为7%。
例4 0.5mol·L-1醋酸溶液的电离度为0.6%.把溶液稀释到0.2mol·L-1,其电离度将是多少?哪个溶液酸性较强?
解 α1=0.6%<5%,c1=0.5,c2=0.2,可用近
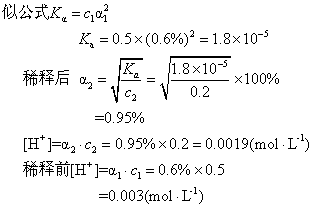
答 溶液稀释后电离度变大由0.6%增至0.95%,而溶液酸性较强的是0.5mol·L-1的溶液。
☚ 酸与碱混合后溶液的pH值计算 水的离子积的计算 ☛
- 卡夫食品公司是什么意思
- 卡子是什么意思
- 卡宴是什么意思
- 卡宾枪是什么意思
- 卡尔加里是什么意思
- 卡尔维诺是什么意思
- 卡尺是什么意思
- 卡布拉尔是什么意思
- 卡帕是什么意思
- 卡帕多西亚是什么意思
- 卡带是什么意思
- 卡式是什么意思
- 卡德纳斯是什么意思
- 卡恩是什么意思
- 卡扎菲是什么意思
- 卡拉是什么意思
- 卡拉OK是什么意思
- 卡拉奇是什么意思
- 卡拉季奇是什么意思
- 卡拉布里亚是什么意思
- 卡拉扬是什么意思
- 卡拉斯是什么意思
- 卡拉曼利斯是什么意思
- 卡拉汉是什么意思
- 卡拉瓦乔是什么意思
- 卡斯帕洛夫是什么意思
- 卡斯特是什么意思
- 卡斯特罗是什么意思
- 卡斯蒂利亚是什么意思
- 卡普兰是什么意思
- 卡普尔是什么意思
- 卡普拉是什么意思
- 卡普里岛是什么意思
- 卡森是什么意思
- 卡波特是什么意思
- 卡洛是什么意思
- 卡洛夫是什么意思
- 卡片是什么意思
- 卡特是什么意思
- 卡特尔是什么意思
- 卡特赖特是什么意思
- 卡秋莎是什么意思
- 卡约是什么意思
- 卡纸是什么意思
- 卡罗尔是什么意思
- 卡翁达是什么意思
- 卡脖子是什么意思
- 卡莱尔是什么意思
- 卡萨布兰卡是什么意思
- 卡萨武布是什么意思
- 卡萨诺瓦是什么意思
- 卡西是什么意思
- 卡西尼是什么意思
- 卡规是什么意思
- 卡诺是什么意思
- 卡路里是什么意思
- 卡车是什么意思
- 卡达尔是什么意思
- 卡迪是什么意思
- 卡通是什么意思