电离常数的计算
电离常数的计算dianli changshu de jisuan
弱电解质在水中只有少部分电离,大部分以未电离的分子形式存在。电离达平衡时,AB![]() A++B-,三者浓度间的关系可表示为
A++B-,三者浓度间的关系可表示为
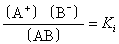
Ki叫做电离平衡常数。习惯上常用Ka表示弱酸的电离常数,Kb表示弱碱的电离常数。电离常数随温度变化而变化,与溶液的浓度无关,它的大小表示弱电解质电离为离子的趋势大小。
电离常数与电离度都能表示弱电解质电离程度的大小,但二者不同。电离常数不受浓度影响,电离度却随浓度而变化,因此各种弱电解质电离的强弱,可用同一温度下各弱电解质的电离常数进行比较。电离常数Ki与电离度α的关系:

例1 某温度下0.01mol·L-1醋酸溶液的电离度为4.2%,求醋酸的电离平衡常数。
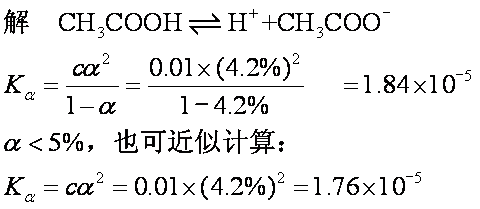
以上两种计算,对10-5数量级来说,Ka值相差甚小。
答醋酸的电离常数为1.84×10-5或1.76×10-5
例2某温度下0.1mol·L-1氨水中OH-浓度为1.33×10-3mol·L-1,求氨水的电离常数。
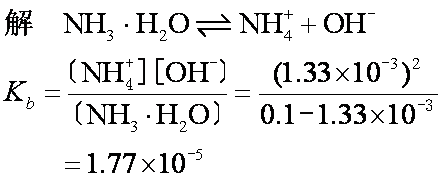
答 氨水的电离常数为1.77×10-5。
例3已知醋酸的电离常数为1.82×10-5,求0.1mol·L-1和0.01mol·L-1醋酸溶液的电离度与氢离子浓度。
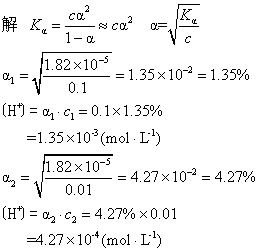
答0.1mol·L-1醋酸溶液的α=1.35%,〔H+〕
=1.35×10-3mol·L-1。
0.01mol·L-1醋酸溶液的 α=4.27%,〔H+〕=4.27×10-4mol·L-1。
由此题看出醋酸浓度变小,其电离度变大,而单位体积内的H+数仍是减少了,即[H+]变小。
以上是讨论一元弱酸或一元弱碱的电离情况,对于多元弱酸,如H2S,H2CO3,在水溶液中是分步电离的,每一步电离都有相应的电离平衡常数。例如
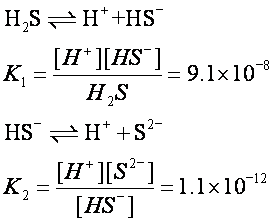
由于K1>>K2,H2S的第二步电离比第一步困难得多,所以在多元弱酸溶液中,H+的主要来源为第一步电离,第二步电离出的H+很少,可以忽略不计。一般计算时用K1就行了。如果要计算[S2-]或[CO2-3],可将两步电离合并写为一式,即
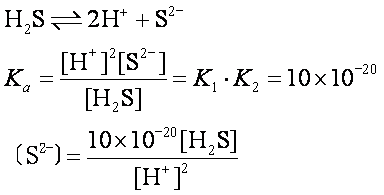
☚ 水的离子积的计算 盐水解的计算 ☛
- 长城绵绵史悠悠是什么意思
- 长城罐头厂是什么意思
- 长城脚下名联堂是什么意思
- 长城自坏是什么意思
- 长城航空公司重庆营业部是什么意思
- 长城记是什么意思
- 长城记·孟姜女送寒衣是什么意思
- 长城谣是什么意思
- 长城赋是什么意思
- 长城路是什么意思
- 长城道傍多白骨。是什么意思
- 长城郡是什么意思
- 长城金银精炼厂是什么意思
- 长城铝业公司是什么意思
- 长城银行是什么意思
- 长城随想是什么意思
- 长城饭店之邀是什么意思
- 长城驿是什么意思
- 长城(集团)公司是什么意思
- 长城)([台湾]白灵)是什么意思
- 长基是什么意思
- 长堆蒲公英是什么意思
- 长堑是什么意思
- 长堤是什么意思
- 长堤要防老鼠洞,大树要防蛀心虫是什么意思
- 长堤鳞波是什么意思
- 长塘湖是什么意思
- 长塞镇是什么意思
- 长墉是什么意思
- 长墓群是什么意思
- 长墙山是什么意思
- 长墟是什么意思
- 长壁工作面是什么意思
- 长壁开采法是什么意思
- 长壁犁(草地犁)是什么意思
- 长壬是什么意思
- 长壮是什么意思
- 长声也么是什么意思
- 长声吆吆是什么意思
- 长声吟咏是什么意思
- 长声声儿是什么意思
- 长声鸣叫是什么意思
- 长处是什么意思
- 长处寻短是什么意思
- 长处掏,短处捏是什么意思
- 长处掐, 短处捏。是什么意思
- 长处,优点是什么意思
- 长复句是什么意思
- 长夏是什么意思
- 长夏城之战是什么意思
- 长夏门是什么意思
- 长外衣是什么意思
- 长多是什么意思
- 长夜是什么意思
- 长夜之乐是什么意思
- 长夜之饮是什么意思
- 长夜冥冥是什么意思
- 长夜台是什么意思
- 长夜如小年是什么意思
- 长夜室是什么意思