热力学第二定律relixue dierdinglu
热力学的基本定律之一。它指明了涉及热现象的一切实际宏观过程进行的方向,概括了热力学过程的不可逆性。19世纪人们研究如何提高热机的效率,热机效率有无上限等问题。1824年法国工程师S.卡诺发表了《论火的动力》的论文,解决了上述两个问题。卡诺实质上已发现了热力学第二定律,但由于当时能量守恒定律尚未建立,卡诺受热质说的影响,未能真正意识到他的工作的意义。R.克劳修斯和开尔文分别研究了卡诺的工作,独立地从卡诺的工作中发现了热力学第二定律,于1850年和1851年提出了各自对热力学第二定律的表述。
热力学第二定律的开尔文表述是:不可能从单一热源吸取热量使之完全变为有用功而不产生其它影响。又可表述为第二类永动机是不可能造成的。在热力学第一定律建立后,人们知道热机效率不能超过100%,但是否能达到100%呢?若一热机在一个循环中从高温热源吸收热量Q1,向低温热源放热Q2,对外做功A,则A=Q1-Q2,热机效率为η=1-Q2/Q1,如果Q2=0就可有η=1的热机,即效率为100%,这样的热机不需要低温热源,所以称为单源热机。如果单源热机能够制成,就可以利用大气和海洋作为取之不尽、用之不竭的能源,因此人们称之为第二类永动机。热力学第二定律的开尔文表述说明单源热机是不可能造成的。实质上是说明功变热过程的不可逆性,功可以全部转换为热量,但热量不可能全部转变为功而不带来其它影响,例如热机完成一个循环,工作物质回到原来状态,则吸收的热量只有一部分转化为有用功,而另一部分要放给低温热源。在理想气体准静态等温膨胀过程中,吸收的热量全部转化为功了,但是产生了其它影响,即气体的体积发生了变化。
热力学第二定律的克劳修斯表述是:热量不能从低温物体传到高温物体而不产生其它影响,或者说热量不能自动从低温传到高温。制冷机可以将热量从低温传到高温,但必须外界对制冷机作功,这就是克劳修斯表述中所说的“其它影响”。克氏表述实质是说明热传导过程的不可逆性。通过严格的逻辑推理,可以证明克氏及开氏两种表述是等价的,即由一种表述可推出另一种表述。两种表述等价说明不可逆过程间存在内在联系,自然界有很多不可逆过程,如扩散,气体向真空膨胀等等,可以证明不可逆过程之间都是相互联系的,若已知一过程为不可逆过程,便可推证另一不可逆过程的不可逆性,所以热力学第二定律可以有多种表述,选择一个不可逆过程,指明其不可逆性,并指出过程进行的方向,即可作为热力学第二定律的一种表述,开氏和克氏表述是两种典型的表述。热力学第二定律的实质是说明一切与热现象有关的实际宏观过程都是不可逆的。克劳修斯于1854年引入热力学函数“熵”,给出了热力学第二定律的数学表述,dS≥dQ/T,式中dS是无限小过程中熵的增量,dQ为系统从热源吸收的热量,T为热源温度,等号对应可逆过程,不等号对应不可逆过程。因为熵是态函数,初末态一定,熵的增量就确定了,在两个状态之间进行的一切可逆过程的dQ/T相等,且等于熵的增量dS,而不可逆过程的dQ/T小于两态间熵的增量。由热力学第二定律可得到熵增加原理,即在一绝热或孤立系统中进行的微小过程,因为dQ=0,必有dS≥0,由此可知,可逆的绝热过程ds=0,为等熵过程。绝热不可逆过程中熵增加,所以在孤立系中,过程是朝着熵增加的方向进行的,最终达到熵的极大值。另一方面孤立系中进行的过程,总是由非平衡态向平衡态方向进行,最后达到平衡态,所以平衡态对应熵值极大。平衡态是系统中粒子处于最混乱(也称为最无序)状态,由统计物理可知,熵与系统状态的热力学概率W的关系为S=klnW。其中k为玻耳兹曼常数,孤立系中过程向着熵增加的方向进行,即由热力学概率小的状态向热力学概率大的状态进行,平衡态的熵值极大对应的热力学概率也极大,这就表明了热力学第二定律的统计意义,宏观不可逆过程的不可逆性是从统计意义上讲的,并非绝对不可逆,例如图1所示气体向真空膨胀,容器A中充满气体,容器B为真空,抽去隔板,气体向真空膨胀,此过程在宏观上是不可逆过程,气体不会自动退回容器A中,从微观上看,分子可任意在两容器中活动,是可逆的。气体自由膨胀的宏观过程是由热力学概率小的状态向热力学概率大的状态进行,相反,气体自动退回容器A中的过程是由热力学概率大的状态向热力学概率小的状态进行,这种可能性不是不存在,只是概率太小,在实际上观测不到,所以说实际上是不会实现的。
热力学第二定律有广泛的应用,由热力学第二定律可以引入一种与测温质、测温属性无关的热力学温标;由热力学第一、第二定律建立起来的热力学基本方程原则上可以解全部平衡态热力学的问题。热力学第二定律不仅适用于实物,也适用于场(如辐射场),但第二定律是在时间、空间都有限的宏观系统中由大量实验事实总结出来的,因此不能用于少数原子、分子组成的系统,也不能简单地推广到时空都无限的宇宙。1951年发现核自旋系统可以处于负温度状态,由于负温度状态比正温度状态的内能更多,系统比正温度状态更“热”,在负温度系统中,热力学第二定律的克氏表述仍适用,开氏表述应改成“不可能从一个正温度热源吸取热量使之完全变为功,或者作功把热量传给一个负温度热源,而不产生其它影响”。因为对于负温度系统来说,单源热机是可能的,例如,可令一可逆卡诺热机工作在负温度的高温热源T1=-50K和低温热源T2=-100K之间,从T1吸热Q1,向T2放热Q2,对外做功W,按卡诺定理有Q2/Q1=T2/T1=-100/-50=2,故Q1=1/2Q2而W=Q1-Q2=-1/2Q2,功为负值,即进行正循环的可逆卡诺热机非但不对外做功,而且要外界对它做功。同理可证,作逆循环的致冷机,如图2所示,从T2热源吸热Q2,对外做正功W=Q2-Q1=1/Q2,同时将Q1=1/2Q2的热量传给高温热源T1,而Q1可以自动由T1传到T2,而两者联合的结果,T1热源复原,唯一的结果是从T2=-100K的热源吸取Q2-Q1的热量对外做功,构成了单源热机。所以在负温度系统中,热功转变的不可逆方向与正温度系统相反,所以开尔文表述要做上述修正。

图1
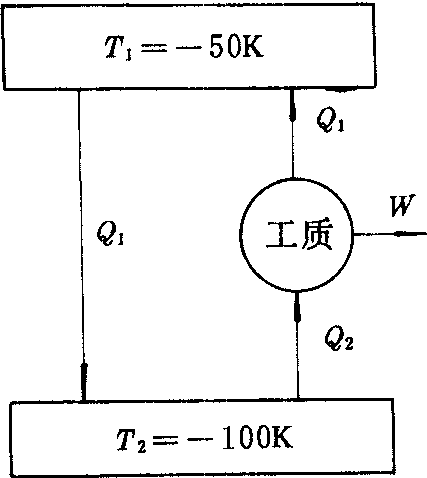
图 2
热力学第二定律
该定律表明:不可能从单一热源吸取热量,使之完全变为有用的功而不产生其他影响(即第二种永动机是不可能造成的)。也可表述为:不可能把热量从低温物体传到高温物体而不引起其他变化。它们都表明:凡是牵涉到热现象的过程都是不可逆的。
热力学第二定律
见“物理”中的“热力学第二定律”。
热力学第二定律
揭示热量运动方向的热力学基本定律。这个定律认为,热量只能从高温物体传到低温物体,不能做相反的传递而不带有其它的变化。就象水只能从高处向低处流,如果想从低处流到高处就必须消耗其它能量一样。该定律还说明,摩擦过程机械功可以全部转化为热,但热不可能回过来全部转化为功。这条定律的确立,宣告了那种试图不提供高温热源,从象海水、空气这样的大物质系统中聚积热量制造第二类永动机的幻想的破灭。热力学第二定律还为现代人类合理利用能源提供了指导思想。尽管人类在利用能源过程中自然界总的能量是不变的,但人类消耗以后的能源以热的形式散失在环境中就不能再利用了。而现今人类利用的煤、石油、天然气等主要能源是有限的,人类在地球上生存的时间将是长期的。所以热力学第二定律在能源利用方面为人类敲起了警钟。
热力学第二定律
热力学基本定律之一,
❶不可能把热从低温物体传到高温物体而不产生其他影响,是德国科学家克劳修斯在1865年提出的;
❷不可能从单一热源取热使之完全转换为有用的功而不产生其他影响;不可逆热力过程中熵的微增量总是大于零,开尔文于1851年提出。
在❶的讲法中,指出了在自然条件下热量只能从高温物体向低温物体转移,而不能由低温物体自动向高温物体转移,也就是说,在自然条件下,这个转变过程是不可逆的。要使热传递方向倒转过来,只有靠消耗功来实现。在
❷的讲法中指出,自然界中任何形式的能都会很容易地变成热,而反过来热却不能在不产生其他影响的条件下完全变成其他形式的能,从而说明了这种转变在自然条件下也是不可逆的。热机能连续不断地将热变为机械功,一定伴随有热量的损失。第二定律和第一定律不同,第一定律否定了创造能量和消灭能量的可能性,第二定律阐明了过程进行的方向性,否定了以特殊方式利用能量的可能性。
热力学第二定律
second law of thermodynamics
- 韩世荫是什么意思
- 韩世钟是什么意思
- 韩世钧是什么意思
- 韩丙富是什么意思
- 韩东山是什么意思
- 韩东山是什么意思
- 韩东山是什么意思
- 韩中日报是什么意思
- 韩中石是什么意思
- 韩中芳是什么意思
- 韩乐然是什么意思
- 韩乐然是什么意思
- 韩乐然是什么意思
- 韩书力是什么意思
- 韩二个是什么意思
- 韩于蜀是什么意思
- 韩云史是什么意思
- 韩云岑是什么意思
- 韩云超是什么意思
- 韩云阶是什么意思
- 韩五九是什么意思
- 韩亚银行是什么意思
- 韩亨允是什么意思
- 韩仁和是什么意思
- 韩仁泽是什么意思
- 韩仁源是什么意思
- 韩仁铭是什么意思
- 韩仁铭是什么意思
- 韩仁铭是什么意思
- 韩令坤是什么意思
- 韩令坤是什么意思
- 韩令坤是什么意思
- 韩令坤是什么意思
- 韩令坤(923—968)是什么意思
- 韩以礼是什么意思
- 韩仲琦是什么意思
- 韩任民是什么意思
- 韩企先是什么意思
- 韩企先是什么意思
- 韩企先是什么意思
- 韩企先(1082—1146)是什么意思
- 韩休是什么意思
- 韩众白鹿是什么意思
- 韩众骑鹿是什么意思
- 韩伟是什么意思
- 韩伟是什么意思
- 韩伟是什么意思
- 韩伟之是什么意思
- 韩伯是什么意思
- 韩伯棠是什么意思
- 韩伯泉是什么意思
- 韩伯複裤(康伯複裤)是什么意思
- 韩伸是什么意思
- 韩何云是什么意思
- 韩余娟是什么意思
- 韩作黎是什么意思
- 韩作黎是什么意思
- 韩侂胄是什么意思
- 韩侂胄是什么意思
- 韩侂胄是什么意思