活化能activation energy
一定温度下,使lmol常态分子转变成活化态分子所需的能量统计平均值。以J/mol表示。一个化学反应体系中,每个分子所具有的能量并不一样,具有较高能量、在有效碰撞中能发生化学反应的分子称为活化分子。活化分子愈多,反应速度愈快。增加活化分子数,一般有两种途径:一是加热或光照,使一部分分子获得能量而活化;二是降低活化能,在不补充能量的情况下,使常态分子容易活化从而增加活化分子数。酶和一般催化剂均可降低反应活化能,酶促反应所需活化能更小,故酶比一般催化剂更可加速所催化的反应。
活化能huohuaneng
通常所说的活化能是指阿仑尼乌斯的活化能,这是S.A.阿仑尼乌斯根据大量的实验提出的一种经验活化能。关于活化能的定义以及对其本质的认识,至今尚未完全统一,常见的说法有3种:
❶ S.A.阿仑尼乌斯的解释 活化能为普通分子转变为活化分子时所需吸收的能量,或是反应物分子中活化分子的能量与未活化分子的能量之差。
❷G.N.路易斯的说法 活化能是活化分子具有的最低能量与所有反应物分子的平均能量之差。
❸ R.C.托尔曼的定义 活化能是活化分子的平均能量与所有反应物分子的平均能量之差。
第一种说法太笼统,第二种说法至今教材仍在采用,第三种说法触及了活化能的微观本质,是比较准确的。但对活化分子的平均能量是否有定值,目前尚有异议。
由于参加基元反应的分子一般不只一种,因此,严格地说,阿仑尼乌斯活化能是1 mol反应物活化分子组(反应碰撞分子对)的平均能量与1 mol反应物分子组(全部反应物碰撞分子对)的平均能量之差。即
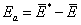
式中
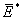 为 1 mol活化分子组的平均能量;
为 1 mol活化分子组的平均能量;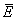 为1mol反应物分子组的平均能量。活化能Ea的单位为kJ·mol。
为1mol反应物分子组的平均能量。活化能Ea的单位为kJ·mol。如反应
A+BC→(A…B…C)*→P(产物)
(A+BC)为反应分子组(反应物碰撞分子对); (A…B…C) *为活化分子组 (反应碰撞分子对)。其活化能为
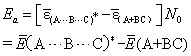
这样定义的活化能不仅考虑A或BC的能量,而且还包括(A+BC) 的总能量。Ea与
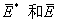 和的关系,见下图。
和的关系,见下图。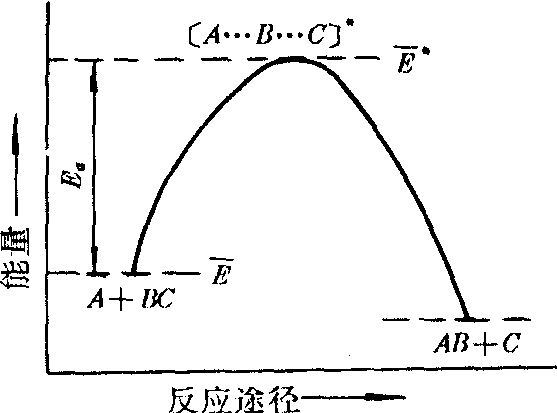
活化能的统计定义示意图
活化能
要使寻常分子变为活化分子所需的最小能量。化学家阿仑尼乌斯首先提出。使分子得到活化能的过程称为“活化作用”。处于活化状态的分子数目愈多,反应速度就愈快。
活化能
activation energy
- 望月砂散是什么意思
- 望月砂汤是什么意思
- 望望然去之是什么意思
- 望望然去之是什么意思
- 望果节是什么意思
- 望果节是什么意思
- 望梅丸是什么意思
- 望梅止渴是什么意思
- 望梅止渴是什么意思
- 望梅止渴是什么意思
- 望梅止渴是什么意思
- 望梅止渴是什么意思
- 望梅止渴是什么意思
- 望梅止渴是什么意思
- 望梅止渴是什么意思
- 望梅止渴(A)是什么意思
- 望梅调是什么意思
- 望梅阁老是什么意思
- 望楼是什么意思
- 望气是什么意思
- 望气是什么意思
- 望气占兆是什么意思
- 望江东·江水西头是什么意思
- 望江东路是什么意思
- 望江亭是什么意思
- 望江亭是什么意思
- 望江亭是什么意思
- 望江亭是什么意思
- 望江亭是什么意思
- 望江亭中秋切鲙旦是什么意思
- 望江南是什么意思
- 望江南是什么意思
- 望江南是什么意思
- 望江南是什么意思
- 望江南是什么意思
- 望江南是什么意思
- 望江南·春未老是什么意思
- 望江南·石屏老是什么意思
- 望江南·西湖四时是什么意思
- 望江南子是什么意思
- 望江南子是什么意思
- 望江南子是什么意思
- 望江南子是什么意思
- 望江南子是什么意思
- 望江县志是什么意思
- 望江梅(二首)是什么意思
- 望江楼公园(薛涛井)是什么意思
- 望江楼图是什么意思
- 望江路是什么意思
- 望江门是什么意思
- 望洋兴叹是什么意思
- 望洋兴叹是什么意思
- 望洋兴叹是什么意思
- 望洋兴叹是什么意思
- 望洋兴叹是什么意思
- 望洋兴叹是什么意思
- 望洋兴叹是什么意思
- 望洋兴叹是什么意思
- 望洋兴叹是什么意思
- 望海#之战是什么意思