活化分子
活化分子huohua fenzi
能量高于某一临界值(低限能量) 的分子叫活化分子。能量低于这个值的分子叫非活化分子或普通分子。分子在运动和碰撞过程中,分子之间不断发生能量交换,使每个分子的能量均在瞬息万变。因此,即便是同类分子,能量相差也很大。这种能量差别使分子分成活化分子和非活化分子。
活化分子和非活化分子并非一成不变。因分子碰撞使有些活化分子会失去能量,变成非活化分子; 而非活化分子可能在碰撞中得到能量,变成活化分子。但在一定温度下,活化分子的数目 (或活化分子所占的百分率) 是不变的。
活化分子比普通分子高出的能量来源于分子的碰撞动能。同一体系中不同种分子活化时所需的能量不同,因此,某种分子活化时,另一种分子不一定被活化。根据玻尔兹曼分布,活化分子的数目为n=n0e-E/RT,式中n0为分子总数,E为活化能,T为温度。显然,活化分子的数目与温度有关。温度升高,反应速率加快,主要原因是活化分子数目增加的结果。
分子的碰撞不同于刚体的碰撞。因分子的电子云是没有界限的,可以相互穿透。当分子相互接近时,将会显著地增大它们之间的斥力,分子运动速率就会减慢,甚至停顿,然后又相互离开。
如果分子运动速率不是非常快,由于两分子的电子云静电斥力,则在发生电子云相互穿透之前可能就停止前进,甚至反向运动,其结果是分子被弹回,而不发生反应。如果分子运动速率相当快,具有很大的动能,足以克服分子电子云的斥力,使电子云相互穿透。当分子电子云相互重迭时,原子核间的电子云与原子核的引力大于原子间的斥力,则原子相互吸引而稳定存在,便形成产物。因此,只有活化分子的碰撞才能引起化学反应。
☚ 反应热的估算 有效碰撞 ☛
- xienx·qix·luf是什么意思
- xienx·qix·sanx是什么意思
- xienx·qix·sirl是什么意思
- xienx·qix·wut是什么意思
- xienx·qix·yif是什么意思
- xie renbao是什么意思
- xiert kox是什么意思
- xiert lert wairx[ʔ-]lairx是什么意思
- xierx是什么意思
- xierx zo qirx是什么意思
- xierx zvnx qirx是什么意思
- xie-xu是什么意思
- xie youwei是什么意思
- xif nirt faf是什么意思
- xijiang 西江是什么意思
- xil是什么意思
- xil bol是什么意思
- xil conl bairt guarx是什么意思
- xil gul yil是什么意思
- xil hainl jienl duart是什么意思
- xil hainl xil hainl是什么意思
- xil hhort是什么意思
- xil hhort jil是什么意思
- xil hhort jil lil ganl xianlqirx是什么意思
- xil hhort zex gainl mortjiant mort suarx是什么意思
- xil hhort〔zil〕suarx ze d-e是什么意思
- xil hul zix是什么意思
- xi li fai lai是什么意思
- xi li fv lv是什么意思
- xiling seal-cutting society是什么意思
- xil jix是什么意思
- xil lil fail lail是什么意思
- xil lil gairt lairt是什么意思
- xil lil hainl lainl是什么意思
- xil lil honl tonl是什么意思
- xil lil hul lul是什么意思
- xil lil suail lail是什么意思
- xil nei是什么意思
- xil no是什么意思
- xil tvnl nei是什么意思
- xil vux qiainl是什么意思
- xil vux yin是什么意思
- xil xil是什么意思
- xil xiorx cet是什么意思
- xil yil是什么意思
- xil yox banl yox是什么意思
- xil zil yil是什么意思
- xil zix sait yvnx是什么意思
- xil zort 〔zex〕是什么意思
- xil·zanrx (xix·zanrl)是什么意思
- x
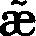 是什么意思
是什么意思 - [x
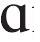
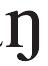 ]是什么意思
]是什么意思 - [x
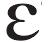 ]是什么意思
]是什么意思 - [x
 u]是什么意思
u]是什么意思 - [x
 ]是什么意思
]是什么意思 - xin是什么意思
- x.i n.=ex interest是什么意思
- xing是什么意思
- xing dian是什么意思
- xinghu是什么意思