水解度
水解度shuijiedu
盐类水解达到平衡时,已水解的盐的分子数与溶解在溶液中的盐的分子总数之比叫盐的水解度。各种盐在相同温度、相同浓度时有不同的水解度。水解生成的酸或碱越弱,则水解度越大。例如,18℃时0.1mol·L-1醋酸钠溶液的水解度是0.008%,而氰化钾在相同条件下的水解度是1.2%。这是由于氢氰酸比醋酸更弱的缘故。溶液越稀,一般水解度越大。在盐溶液中加入酸或碱,则水解度减小。水解是中和的逆反应,中和是放热反应,故水解是吸热反应,升温使水解度增大。由1价阳离子和1价阴离子形成的盐,其水解度h(以%计)可用下式计算:
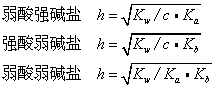
式中Kw是水的离子积,c是盐的物质的量浓度,Ka,Kb分别是弱酸和弱碱的电离常数。由上述公式可看出浓度及酸、碱的强弱对水解度的影响。
☚ 盐效应 水解常数 ☛
- 宅子是什么意思
- 宅屋是什么意思
- 宅第是什么意思
- 宅舍是什么意思
- 宅门是什么意思
- 宅院是什么意思
- 宇是什么意思
- 宇内是什么意思
- 宇宙是什么意思
- 宇宙学是什么意思
- 宇宙射线是什么意思
- 宇宙尘是什么意思
- 宇宙火箭是什么意思
- 宇宙空间是什么意思
- 宇宙线是什么意思
- 宇宙观是什么意思
- 宇宙速度是什么意思
- 宇宙飞船是什么意思
- 宇文是什么意思
- 宇文氏是什么意思
- 宇文泰是什么意思
- 宇称是什么意思
- 宇航是什么意思
- 宇航员是什么意思
- 宇航器是什么意思
- 宇航服是什么意思
- 守是什么意思
- 守业是什么意思
- 守丧是什么意思
- 守信是什么意思
- 守候是什么意思
- 守兵是什么意思
- 守军是什么意思
- 守分是什么意思
- 守则是什么意思
- 守制是什么意思
- 守势是什么意思
- 守卫是什么意思
- 守口如瓶是什么意思
- 守土是什么意思
- 守土有责是什么意思
- 守墓是什么意思
- 守备是什么意思
- 守夜是什么意思
- 守孝是什么意思
- 守宫是什么意思
- 守寡是什么意思
- 守将是什么意思
- 守岁是什么意思
- 守御是什么意思
- 守恒是什么意思
- 守成是什么意思
- 守护是什么意思
- 守摊子是什么意思
- 守擂是什么意思
- 守敌是什么意思
- 守旧是什么意思
- 守时是什么意思
- 守服是什么意思
- 守望是什么意思