水的离子积的计算
水的离子积的计算shui de liziji de jisuan
水是很弱的电解质,有微弱的电离,25℃时1L纯水中有10-7mol水分子电离。由方程H2O![]() H++OH-知其电离平衡常数
H++OH-知其电离平衡常数
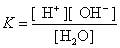
[H+]=[OH-]=10-7mol·L-1
1L纯水重1000g为55.5mol,达平衡时[H2O]5.5-10-7=55.1mol为 一常数,将两个常数合并为一项
K[H2O]=[H+]·[OH-]
Kw=K〔H2O〕=〔H+〕〔OH-〕=10-14
称KW为水的离子积常数,它表明在水溶液中H+浓度与OH-浓度的乘积为一常数。
纯水中加入酸或碱后,水的电离平衡向左移动,水电离产生的H+和OH-减少。此时溶液中的H+或OH-主要来自酸或碱的电离,水本身电离出的H+或OH-浓度小到忽略不计的程度,由于溶液中存在水的电离平衡,溶液中[H+]与[OH-]的乘积为常数Kw。由已知[H+]或[OH-]和Kw可计算另一种离子的浓度。
例1 求0.01mol·L-1硫酸溶液中OH-浓度。解 0.01mol·L-1 H2SO4溶液中[H+]=0.02 mol·
L-1
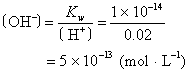
答 该溶液中 OH-的浓度为 5×10-13mol·L-1。
例2 求0.1mol·L-1醋酸溶液的OH-浓度。
解 醋酸是弱电解质只部分电离,查得此溶液的电离度α=1.34% 。
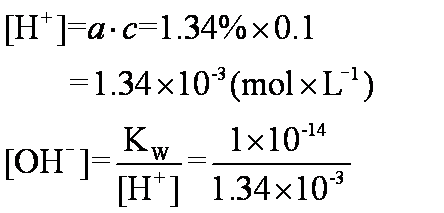

答 0.1mol· L-1氢氧化钠溶液H+浓度为10-13mol·L-1。
☚ 电离度的计算 电离常数的计算 ☛
- 溜欢是什么意思
- 溜欢儿地是什么意思
- 溜步是什么意思
- 溜水是什么意思
- 溜汾是什么意思
- 溜沙是什么意思
- 溜沙坡是什么意思
- 溜沟是什么意思
- 溜沟儿是什么意思
- 溜沟子是什么意思
- 溜沟子舔腚是什么意思
- 溜沟子货是什么意思
- 溜沟子(货)是什么意思
- 溜沟抹槽是什么意思
- 溜沟沟话是什么意思
- 溜沟涮棒是什么意思
- 溜沟舔腚是什么意思
- 溜沟鬼是什么意思
- 溜油光是什么意思
- 溜沿儿是什么意思
- 溜泊儿是什么意思
- 溜洋国是什么意思
- 溜洒是什么意思
- 溜活是什么意思
- 溜活儿是什么意思
- 溜活的是什么意思
- 溜派是什么意思
- 溜浆大泡是什么意思
- 溜浪是什么意思
- 溜海是什么意思
- 溜海子是什么意思
- 溜渣是什么意思
- 溜湫是什么意思
- 溜湫儿的是什么意思
- 溜湾是什么意思
- 溜湾儿是什么意思
- 溜湾子是什么意思
- 溜湿是什么意思
- 溜溜是什么意思
- 溜溜儿是什么意思
- 溜溜儿的是什么意思
- 溜溜光是什么意思
- 溜溜啾啾是什么意思
- 溜溜圆是什么意思
- 溜溜地是什么意思
- 溜溜子是什么意思
- 溜溜子光是什么意思
- 溜溜尖是什么意思
- 溜溜尖兮是什么意思
- 溜溜手是什么意思
- 溜溜拉拉扯下这么长是什么意思
- 溜溜拍拍是什么意思
- 溜溜曲曲是什么意思
- 溜溜板是什么意思
- 溜溜湫湫是什么意思
- 溜溜湫湫溜溜啾啾是什么意思
- 溜溜灯是什么意思
- 溜溜球是什么意思
- 溜溜球球是什么意思
- 溜溜的是什么意思