放射性核素标记物的生物合成
放射性核素标记物的生物合成,就是利用植物、微生物或动物作为“化学工厂”,制备所需要的放射性核素制剂。可以用完整的生物,以简单的放射性核素化合物为原料,在生物体内经多步反应合成复杂的标记物,通常称为“全生物合成”。也可利用生物组织中某种特定的酶(提纯的酶、酶制剂或含有酶的组织)来担任标记物的合成工作,称为酶促合成。特别是对于一些构造复杂、化学合成难以完成或目前尚不可能制备的有机化合物,生物合成法常是制备标记物最有用的手段。
全生物合成 全生物合成的主要优点: 不论化合物结构如何复杂,只要有分离提纯的手段,就可用全生物合成法制备,标记原料的来源不受有机合成的限制。此外,产品是和生物体内大量存在的化合物相同的光学异构体,而不是外消旋混合物,因而特别适合于各种示踪工作。这对于制备分子内含有许多不对称碳原子的有机化合物(如糖类、固醇类)尤其有价值。全生物合成往往生成许多位置上同时带标记的分子,若体内不存在非标记的原料,可以得到比放射性很高的化合物。有时还可一次实验得到多种标记产品。
全生物合成的主要缺点:
❶产物的标记位置常不是严格定位的,对需要严格定位标记的示踪实验不适用;
❷制备过程中常产生一系列结构和性质近似的标记物,以致产物的分离纯化比一般化学合成更困难;
❸由于完整生物体内有许多代谢旁路,多数情况下标记原料的利用率(产率)常很低。例如用标记甘氨酸喂给或注射给动物以制备标记的血浆白蛋白,绝大部分原料将进入代谢旁路;
❹如果生物机体还有其他来源获得非标记的原料,如摄入或合成,则标记产物的比放射性往往不高;
❺不适用于制备高比放射性的3H化合物,因为即使1%丰度的氚水(相当于每ml 30Ci)也会有每天高达107rad的辐射剂量,可导致杀伤生物细胞的严重后果。
全生物合成最常采用细菌、绿藻、酵母等低等生物来进行。这些生物易于在实验室培育,代谢活泼,繁殖迅速,故制备效率较高。例如利用蛋白质含量高的小球藻进行光合作用,使14CO2参入到细胞体内。从标记的小球藻提取蛋白质,用层析法分离蛋白水解液,可得到16种14C全标记(即各个碳原子上都有14C标记)的氨基酸,包括丙、精、门冬、谷、甘、组、亮、异亮、頼、蛋、脯、苯丙、丝、苏、酪和缬等氨基酸。产品全部是L型光学异构体,比放射性也是令人满意的。显然,这种方法比用化学方法分别制备16种14C标记氨基酸方便,也经济得多。为了充分利用原料,培养液和各部分残渣可通过氧化而回收14CO2。
此外,用酵母将35S-硫酸钠加工成25S-L-蛋氨酸;用灰色链球菌或橄榄色链球菌以60CoCl2为原料制备60Co-维生素B12;用巴龙霉菌以氚水(10mCi/ml)为原料合成3H-巴龙霉素等,也都是有代表性的实例。
利用高等植物制备某些用低等生物不能制备的标记化合物,有时效果很好。例如利用光合作用制备多糖或单糖。将土耳其烟草在强光照射下暴露于14CO2的气体中,18~24小时后用乙醇提取。不溶部分含有14C-淀粉,以酸水解即得结晶的葡萄糖。乙醇提取液中则存在着葡萄糖、果糖及蔗糖。这三种14C标记的糖可用离子交换树脂柱提纯,并用纸层析分开。14CO2的放射性约有70%参入到三种糖中,葡萄糖、蔗糖及果糖的放射性分别占21%、29%及20%。还可利用高等植物制备14C标记的植物药有效成分,对这些药物的药理研究有重要意义。也可以用高等动物制备其他方法不易或不能制备的标记化合物。早年用高等动物制备过多种标记的生理物质,曾在示踪研究中起重要作用。例如给母鸡腹腔注射14C-乙酸,可从鸡蛋的卵黄中提取到14C-胆固醇。又如给缺碘的大鼠注射Na131I,可从血浆中提取比放射性很高的131I-甲状腺素。目前,这些生物合成大多已被化学合成法取代。但当某些化合物还不能利用化学法标记时,用高等动物进行生物合成仍不失为一种有用的标记方法。例如前列腺素的某些代谢产物,其标记物可通过给动物引入标记前列腺素,再从尿中分离其代谢产物而获得。
酶促合成 酶促合成是利用某些特定的酶,通过一步或少数几步反应将标记前身物转变为所需要的标记产物。因此,这种合成也可看作是应用特殊催化剂的化学合成。它的主要优点是: 能解决一般化学合成不能解决的合成问题; 使用定位标记的前身物可以得到定位标记的产物;其标记位置可以根据需要预先设计;产物的比放射性与前身物的比放射性相当,可以很高;产物具有光学异构特性,特别适合于作生物示踪实验。此外,酶促反应有时相当快,制备周期常可较短。
酶促合成所用的生物体系有: “纯”酶或纯度很高的结晶酶;粗酶体系,即组织提取液,或经过部分纯化的酶制剂; 核蛋白体复合物(用于合成蛋白质)、溶菌酶体系、线粒体等酶混合物;全细胞匀浆;组织切片和动植物的一部分,如用营养液灌流的动物器官或植物的根、茎、叶等。用“纯”酶进行生物合成可以严格控制反应条件,排除其他酶的干扰,标记原料的利用率较高,产品的纯度也容易得到保证。目前制备高纯度的γ-22P-ATP及α-32P-ATP,就是用几种“纯”酶,分几步完成的。
但是,在大多数情况下,用粗酶体系也可获得较满意的结果。例如3H或14C标记胸腺嘧啶核苷的制备。先用化学方法合成3H或14C定位标记的胸腺嘧啶,然后用大鼠肝组织的提取液使标记胸腺嘧啶和非标记的尿嘧啶脱氧核苷起反应,将脱氧核糖转移到胸腺嘧啶上去,最后只需二步纸层析分离,即可得到高纯度的标记胸腺嘧啶核苷,其比放射性与标记胸腺嘧啶相近。
如果某一标记物需要几步酶促反应,有时可以用酶混合物,特别是有些酶混合物本来就存在于细胞内的某一组成部分,只需将这一组分分离出来,即可使用,例如用大鼠肝脏的线粒体制备22P-ATP(β、γ位置标记,不严格定位)。大鼠(或小鼠)肝匀浆低速离心分出的上清液,经1,000g离心除去细胞核后,再经10,000g高速离心得到线粒体。将此线粒体悬浮在蔗糖水溶液中,加AMP、Mg++等氧化磷酸化系统和Na2H32PO4,在28~30℃进行反应,40~50分钟即可得到高比放射性的32P-ATP,32P无机盐的利用率约90%。
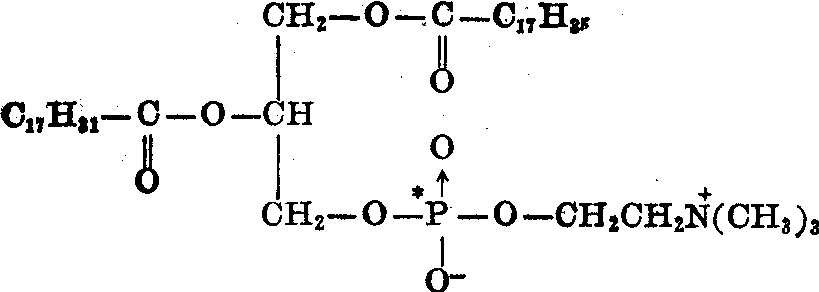
如果所需要的标记化合物是某种组织合成代谢或分解代谢的终点产物,则直接用组织切片、灌流器官、甚至植物的根、茎、叶等也可得到较满意的生物合成产品。例如用大鼠肝切片制备32P-卵磷酯及32P,14C-卵磷酯。切片于37℃在pH7.2的Krebs-Ringer碳酸氢钠缓冲液中保温,内加32P-KH2PO4、三磷酸胞苷、乙酸钠及葡萄糖。6小时后用脂肪溶剂提取脂质,并用薄板层析分离。通过放射自显影确定卵磷脂的位置; 再将此标记部分刮下,用氯仿及甲醇洗脱,便得到纯32P-卵磷脂。
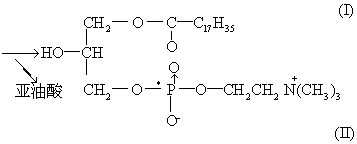
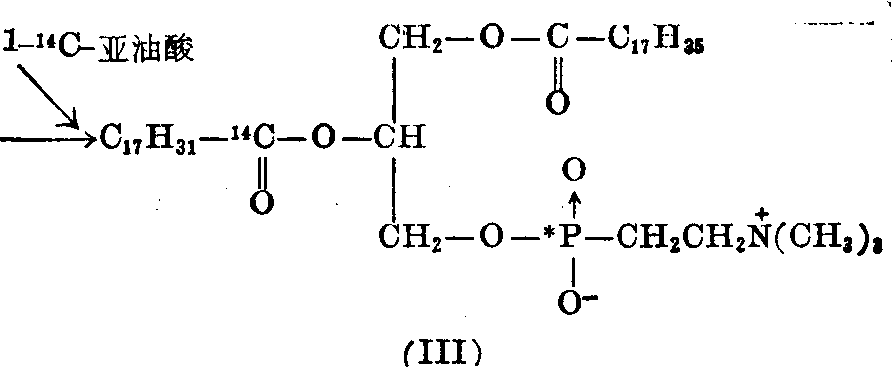
上述32P-卵磷脂(I)用磷酸脂酶A降解,除去一分子亚油酸,再与 (1-14C)亚油酸在超声波作用下分散于含ATP和辅酶A的Krebs-Ringer溶液中,再加肝匀浆保温,可以得到32P,14C-双标记的卵磷脂(Ⅲ)。
文献中关于生物合成的资料很多,但其中只有一小部分适合于用来生产标记化合物。这是因为作为一种制备方法,必须能获得足够数量的、具有较高比放射性的产品。为此,关键在于寻找最佳反应条件。例如在酶促合成中,需要进行一系列实验以确定酶、底物及放射性原料的最适浓度、反应的最适时间及最适pH等。又如在光合作用中,需要确定最佳光照方式、引入14CO2的最佳时期、最佳的植物品种、用量及培养方法等。总之,每一个满意的生物合成标记法都需通过大量的试制研究才能建立起来。
- 湖南提督是什么意思
- 湖南提督衙门是什么意思
- 湖南摔跤队是什么意思
- 湖南摩托艇队是什么意思
- 湖南摩托车队是什么意思
- 湖南政报是什么意思
- 湖南政治年鉴是什么意思
- 湖南教育是什么意思
- 湖南教育会是什么意思
- 湖南教育会图书馆是什么意思
- 湖南教育出版社是什么意思
- 湖南教育学会是什么意思
- 湖南教育学院是什么意思
- 湖南教育学院学报是什么意思
- 湖南教育学院报是什么意思
- 湖南教育对外交流活动是什么意思
- 湖南教育报是什么意思
- 湖南教育报刊社是什么意思
- 湖南教育援藏是什么意思
- 湖南教育援藏概况是什么意思
- 湖南教育杂志是什么意思
- 湖南教育电视台是什么意思
- 湖南教育行政汇刊是什么意思
- 湖南教育音像出版社是什么意思
- 湖南散文选是什么意思
- 湖南文化事业教育是什么意思
- 湖南文化事业经费是什么意思
- 湖南文化大厦是什么意思
- 湖南文化娱乐中心是什么意思
- 湖南文化界抗敌后援会是什么意思
- 湖南文化音像出版社是什么意思
- 湖南文史是什么意思
- 湖南文史资料选辑是什么意思
- 湖南文学是什么意思
- 湖南文学史是什么意思
- 湖南文学艺术期刊是什么意思
- 湖南文学艺术概况是什么意思
- 湖南文征是什么意思
- 湖南文抗会绘画工作团是什么意思
- 湖南文物事业概况是什么意思
- 湖南文理学院是什么意思
- 湖南文艺出版社是什么意思
- 湖南文艺广播电台是什么意思
- 湖南新文学七十年是什么意思
- 湖南新旧文学之争是什么意思
- 湖南新时期10年优秀文艺作品选·戏剧卷是什么意思
- 湖南新时期10年优秀文艺作品选·杂文卷是什么意思
- 湖南新时期十年优秀文艺作品选·儿童文学卷是什么意思
- 湖南新时期十年优秀文艺作品选·小说卷 (上、下册)是什么意思
- 湖南新时期十年优秀文艺作品选·散文报告文学卷是什么意思
- 湖南新时期十年优秀文艺作品选·文艺理论卷 (上、下册)是什么意思
- 湖南新时期十年优秀文艺作品选·电视卷是什么意思
- 湖南新时期十年优秀文艺作品选·诗歌卷是什么意思
- 湖南新闻工作队伍是什么意思
- 湖南方物志是什么意思
- 湖南方言的动态助词是什么意思
- 湖南方言研究丛书是什么意思
- 湖南旅游发展有限责任公司是什么意思
- 湖南旅游图是什么意思
- 湖南旅游图书是什么意思