反应热
反应热fanyingre
当反应产物和反应物的温度相同、反应过程不做非体积功时,化学反应所吸收或放出的热,叫化学反应热效应。化学反应时之所以伴随着吸热或放热现象,是由于化学反应改变了物质分子的结构,或者说,化学反应时分子中化学键的性质及数目均发生了变化,在相同条件下,反应产物的总能量与已反应的反应物的总能量不相同,即
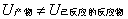
这种能量的变化是通过热和功的形式与环境进行交换的结果。热化学中规定: 反应体系吸热,Q为正值; 反应体系放热,Q为负值。
如果是电化学反应,体系做了电功,即存在非体积功,这时体系与环境之间交换的热,称为过程热,而不是反应热。反应热在数值上应是过程热与非体积功之和,即
反应热=过程热+非体积功
通常热效应包括反应热、相变热(潜热)、溶解热、稀释热和混合热。除此之外的其他过程中,即便不做非体积功,体系与环境间交换的热,也不叫热效应,只称过程热。
热与过程有关。反应条件不同,反应热是不一样的。根据热化学反应的条件,反应热一般有两种,即等压反应热和等容反应热。如果在等温等压、不做非体积功时,化学反应所吸收或放出的热叫等压反应热。由于反应体系不做非体积功,又是等压过程,热力学中可以证明Qp=△H,式中Qp为等压反应热;△H为反应过程焓的变化。所以,热化学中等压反应热直接用△H表示。如果在等温等容、不做非体积功时,化学反应所吸收或放出的热叫等容反应热,符号记作QV。热力学中同样可证明QV=△U,式中△U为反应前后体系内能的变化。等压反应热与等容反应热的关系,由热力学导出
△H-△U=p△V 或 Qp=QV-p△V
式中p为压力; △V为反应前后体系体积的变化。说明同一反应的等压反应热与等容反应热大约相差p△V ,显然是因反应在等温等压下进行有体积变化所致。
应用时有下列几种情况:
若是气相反应,气体通常可视为理想气体,于是存在
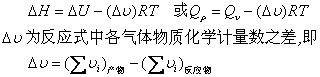
若是凝聚相(固、液相)反应,反应前后体积变化
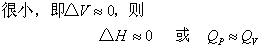
如果反应体系中只有部分物质是气体,而气体也可视为理想气体,则
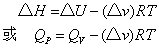
仍适用。不过式中的△v仅指反应前后气体物质的化学计量数之差,反应前后凝聚相物质体积的变化可忽略。
☚ 反应进展度 生成热 ☛
反应热
heat of reaction;reaction heat
- 1.年平均各级风速频率和最大风速的分布是什么意思
- 1.年平均气温及其分布是什么意思
- 1.年降水分布及变率。是什么意思
- 1.年降水量的空间分布是什么意思
- 1.年龄结构是什么意思
- 1年~60年是什么意思
- 1. 广州市是什么意思
- 1.广播种类是什么意思
- 1.广泛宣传,精心准备是什么意思
- 1 庄子和他的时代是什么意思
- (1)库存是什么意思
- 1. 库尔勒市是什么意思
- (1)店铺类型是什么意思
- 1. 延安市是什么意思
- 1.延安市水利科学研究所是什么意思
- 1.建成了一批农田水利工程是什么意思
- 1.建成了一批水利工程是什么意思
- 1.建材工业是什么意思
- (1)建材种类是什么意思
- 1.建立了一定数量的少数民族乡政权是什么意思
- 1.建立体育组织是什么意思
- 1.建立健全乡村集体经济组织是什么意思
- 1.建立健全了四级商业网络是什么意思
- 1.建立健全村合作经济组织是什么意思
- 1.建立承包责任制是什么意思
- 1.建立森林防火指挥机构是什么意思
- 1.建立流转机制是什么意思
- 1.建立省、市、县、乡农民体育网络是什么意思
- (1)建筑和建筑物是什么意思
- 1.建筑机构和人员是什么意思
- (1)建筑机械是什么意思
- 1.建设内容是什么意思
- 1.开发规模是什么意思
- 1.开发阶段与规模是什么意思
- 1.开展多项或单项农业资源调查时期是什么意思
- 1.开展大宗农产品的综合标准化是什么意思
- 1.引泾灌溉是什么意思
- 1.引进、试验阶段(50—60年代)是什么意思
- 1.引进和培育林木良种是什么意思
- 1.引进国外农作物优良品种是什么意思
- 1. 张家口市是什么意思
- 1.强化政府行为,以法治教是什么意思
- 1.强化领导责任机制是什么意思
- (1)律师是什么意思
- 1. 徐州市是什么意思
- 1.徐淮地区徐州农业科学研究所是什么意思
- (1)微分学是什么意思
- 1.德国文学作家是什么意思
- 1. 德州市是什么意思
- 1 心理是什么意思
- 1. 忻州市是什么意思
- 1.思想感情是什么意思
- 1.思想认识有了飞跃是什么意思
- 1.性别与民族是什么意思
- 1.性别比是什么意思
- 1.性别比例是什么意思
- 1.性别结构是什么意思
- 1.总人口的增长是什么意思
- 1.总体结构是什么意思
- 1.总土地面积广,土地利用率低,人均耕地数量不断下降是什么意思