分压定律的计算
分压定律的计算fenya dinglu dejisuan
均匀混合气体的压力等于各组分气体的分压力之和,称道尔顿分压定律,简称分压定律,它只适用于理想气体。所谓组分的分压力,是指在混合气体中占有与该组分相同的物质的量,在相同温度下,单独占有相同体积时的压力。混合气体中的两种组分的分压和物质的量分别用p1,p2,n1,n2表示。气态方程式分别用于各组分,在相同状况下,p1V=n1RT,p2V=n2RT,所以p1/p2=n1/n2,表明在相同状况下,两种气体的压力比等于它们的物质的量比。
例 某一定体积的密闭容器中,放入8mol氢气、4mol氮气,某温度下反应达到平衡,尚有3.2mol氢气,问❶平衡时容器内的压力是反应前压力的百分之几?
❷若平衡体系压力是2.026×107Pa,求氨气的分压。
解❶设反应前后气体总物质的量和总压力分别为n始,n平,p始,p平,则

❷ 设平衡时氨的分压力和物质的量分别为p(NH3),n(NH3),则:
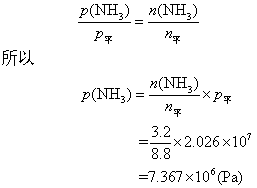
答
❶ 平衡时容器内的压力是反应前压力的73.3%;
❷ 平衡时氨的分压是7.367×106Pa。
☚ 气态方程式的计算 气体在非标准状况下的体积 ☛
- 倒了碾子砸了磨盘——石打石是什么意思
- 倒了高家堰,淮扬不见面是什么意思
- 倒争是什么意思
- 倒二是什么意思
- 倒二宝是什么意思
- 倒二爷是什么意思
- 倒二窝是什么意思
- 倒于脸是什么意思
- 倒亏是什么意思
- 倒井是什么意思
- 倒产是什么意思
- 倒产子死方是什么意思
- 倒仆是什么意思
- 倒仆蹴损是什么意思
- 倒仓是什么意思
- 倒仔是什么意思
- 倒付利息是什么意思
- 倒仙是什么意思
- 倒代是什么意思
- 倒仰是什么意思
- 倒仰儿是什么意思
- 倒仰(儿)是什么意思
- 倒伎是什么意思
- 倒伏是什么意思
- 倒伏在地是什么意思
- 倒伏荆芥是什么意思
- 倒休是什么意思
- 倒休着是什么意思
- 倒伞征是什么意思
- 倒伞麻瓜是什么意思
- 倒伤是什么意思
- 倒位是什么意思
- 倒位杂种是什么意思
- 倒体是什么意思
- 倒作是什么意思
- 倒倒是什么意思
- 倒倒写是什么意思
- 倒倒冷是什么意思
- 倒倒子是什么意思
- 倒倒子脚是什么意思
- 倒倒溜溜是什么意思
- 倒倒种是什么意思
- 倒倒脚是什么意思
- 倒倒脚儿是什么意思
- 倒倒脚(儿)是什么意思
- 倒倒酣酣是什么意思
- 倒值多的是什么意思
- 倒倾是什么意思
- 倒偃是什么意思
- 倒傻是什么意思
- 倒像是什么意思
- 倒儠匠是什么意思
- 倒儿是什么意思
- 倒儿堂是什么意思
- 倒儿爷是什么意思
- 倒儿的亮个是什么意思
- 倒儿的尖亮个是什么意思
- 倒儿蹲是什么意思
- 倒入式是什么意思
- 倒八字步是什么意思