催化作用的基本特征
催化作用的基本特征cuihua zuoyong de jibentezheng
❶ 催化剂能改变反应速率,但不能改变化学平衡。催化剂能加快反应速率,其原因尚未完全弄清。目前较一致的看法认为,在催化反应中,催化剂参与中间过程,形成中间产物,随即分解为原催化剂和反应产物。因此,催化剂的存在改变了反应机理,使化学反应按新的途径进行,进而降低了反应的活化能,加快了反应速率(见下图)。催化剂虽然参
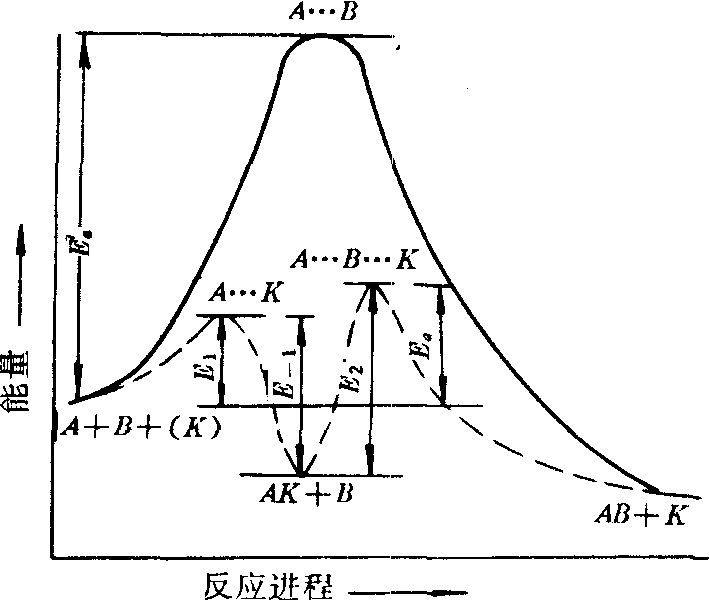
催化剂对反应跃径和活化能的影响示意图
与化学反应,但反应前后其状态不变,故不可能改变反应的
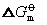 数值。又
数值。又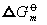 =-RT1nK,因而也不能改变化学反应的平衡常数K。根据K=K1/K-1,因K为定值,说明催化剂在加速正向反应的同时,也必然以同等倍数加速逆向反应。故催化剂只能缩短反应达到平衡的时间。
=-RT1nK,因而也不能改变化学反应的平衡常数K。根据K=K1/K-1,因K为定值,说明催化剂在加速正向反应的同时,也必然以同等倍数加速逆向反应。故催化剂只能缩短反应达到平衡的时间。❷ 催化剂不能改变反应的方向,即不能使热力学上不可能进行的反应发生。因催化剂不会改变体系△Gm的正、负号。
❸催化剂具有特殊的选择性,一种催化剂一般只加速 一种特定类型的反应。这是因为各种催化剂对不同反应有不同的活性。催化剂的选择性在生产实践中是很有意义的,它可使人们在指定时间内消耗同样数量的原料而得到更多的目的产品。科研和生产上常用下式定义:

❹ 催化剂具有稳定性。依催化剂定义,从理论上讲,催化剂可以无限期地使用下去。实践证明,催化剂经过一定时间使用后,将会因温度、压力、摩擦及化学物质等因素的影响,使其化学结构、表面性质和结晶状态等逐渐发生变化,催化活性也随之逐渐衰减,以至最后完全不能用。这一现象称做催化剂的衰老。少量毒物经化学或其他作用,破坏催化剂的活性,使其中毒。催化剂抵抗衰老和中毒的能力称做催化剂的稳定性。稳定性越好,连续使用的时间就越长。催化剂的活性、选择性和稳定性是衡量催化剂性能的3个主要指标。
❺ 催化剂虽然参与化学过程,但反应后恢复原态。故在计量反应中催化剂可省略,仅作条件注明。
☚ 催化剂 水的催化作用 ☛
- 油紙扇是什么意思
- 油素是什么意思
- 油紫是什么意思
- 油絮塌是什么意思
- 油絲絹是什么意思
- 油絹是什么意思
- 油繖是什么意思
- 油纯是什么意思
- 油纳纳是什么意思
- 油纸是什么意思
- 油纸扇是什么意思
- 油纸捻子是什么意思
- 油纸暖帘是什么意思
- 油纸蒲扇是什么意思
- 油纸遮是什么意思
- 油线是什么意思
- 油络是什么意思
- 油绞是什么意思
- 油绢是什么意思
- 油绢衣是什么意思
- 油绳是什么意思
- 油绸伞是什么意思
- 油绿是什么意思
- 油缸是什么意思
- 油缸里的皮球——又圆又滑是什么意思
- 油缸里的西瓜——抓不住是什么意思
- 油缸里的鸡蛋——摸不住抓不牢是什么意思
- 油罂是什么意思
- 油罂把是什么意思
- 油罐是什么意思
- 油罐交接是什么意思
- 油罐冲洗机是什么意思
- 油罐呼吸是什么意思
- 油罐场是什么意思
- 油罐标尺是什么意思
- 油罐检查工是什么意思
- 油罐汽车是什么意思
- 油罐车是什么意思
- 油罗口工程是什么意思
- 油罗树是什么意思
- 油罗罗是什么意思
- 油羊朵落是什么意思
- 油翅是什么意思
- 油老是什么意思
- 油老虎是什么意思
- 油老鼠是什么意思
- 油耗是什么意思
- 油耗仪是什么意思
- 油耗子是什么意思
- 油耗气是什么意思
- 油耳是什么意思
- 油耳朵是什么意思
- 油肉是什么意思
- 油肉芽肿是什么意思
- 油肭肭是什么意思
- 油肿赤硫丹是什么意思
- 油胀果子是什么意思
- 油胞是什么意思
- 油胡桃是什么意思
- 油胡芦是什么意思